
����Ŀ��ij�����A������KAl(SO4)2��Al2O3��Fe2O3����һ�������¿�ʵ����ͼ��ʾ������֮��ı仯��

�ݴ˻ش��������⣺
��1��I��II��III��IV�IJ�������ȡ�ķ��뷽����___________________��
��2������������ͼ��Ӧ��ϵ��д������B��C��D��E�������ʵĻ�ѧʽ
��������B____________________��C_________________________������D ______________����ҺE�е�����____________________��
��3��д�����������������ĸ���Ӧ����ʽ�������ӷ�Ӧ��д���ӷ���ʽ��
��____________________________________________________________________��
��__________________________________________________________��
��____________________________________________________________________��
��__________________________________________________��
���𰸡� ���� Al2O3 Al2O3��Fe2O3 Fe2O3 K2SO4��(NH4)2SO4 Al2O3��2OH- �� 2AlO2- �� H2O Al3+ + 3NH3��H2O��Al(OH)3��+ 3NH4+ AlO2-��H+��H2O��Al(OH)3�� 2Al(OH)3![]() Al2O3��3H2O
Al2O3��3H2O
��������Al2O3��Fe2O3������ˮ�������CΪAl2O3��Fe2O3������������Ӧ�������DΪFe2O3����Ӧ�ڢ������ɵij���ΪAl(OH)3�������������ȷֽ���������������BΪAl2O3����Ӧ��ΪKAl(SO4)2����ˮ�ķ�Ӧ������ҺEΪK2SO4��(NH4)2SO4�Լ�������NH3��H2O��
��1�����벻���Թ������Һ�ķ���Ϊ���ˣ����Ԣ��IJ��ж�����Һ�ͳ����ķ��뷽��Ϊ���ˣ���2��������������֪��BΪAl2O3��CΪAl2O3��Fe2O3��DΪFe2O3����ҺE�е�������Ҫ��K2SO4��(NH4)2SO4����3����Ӧ����������������������Һ�ķ�Ӧ��Al2O3��2OH����2AlO2����H2O����Ӧ�����������백ˮ�ķ�Ӧ��Al3++3NH3��H2O��Al(OH)3��+3NH4+����Ӧ����ƫ����������������ķ�Ӧ��AlO2����H+��H2O��Al(OH)3������Ӧ�������������ֽ⣺2Al(OH)3![]() Al2O3��3H2O��
Al2O3��3H2O��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����A������Al2(SO4)3��Al2O3��Fe2O3����һ�������¿�ʵ����ͼ��ʾ�ı仯��

��ش��������⡣
��1��ͼ���漰������Һ������ķ�����__________________��
��2��B��C��D��E 4�����ʵĻ�ѧʽΪ��B_________��C_________��D_________��E_________��
��3������F��NaOH��Һ��Ӧ�����ӷ���ʽΪ__________________________________������E��ϡ���ᷴӦ�����ӷ���ʽΪ__________________________________________����ҺG�����ϡ��ˮ��Ӧ�Ļ�ѧ����ʽΪ______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������г���NO2 �� �����ֲ�ͬ�����·�����Ӧ��2NO2��g��2NO��g��+O2��g����ʵ����NO2��Ũ����ʱ��ı仯���±�������������N2O4��
| 0 | 10 | 20 | 30 | 40 | 50 |
ʵ��1/800 | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
ʵ��2/800 | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
ʵ��3/850 | 1.00 | 0.50 | 0.40 | 0.15 | 0.15 | 0.15 |
����˵����ȷ���ǣ� ��
A.ʵ��2��ʵ��1�ķ�Ӧ������ѹǿ��С
B.ʵ��2��ʵ��lʹ����Ч�ʸ��ߵĴ���
C.ʵ��1��ʵ��3��ƽ�ⳣ����
D.ʵ��2��ʵ��3���жϸ÷�Ӧ�Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�������ʵ��С��ֱ�������ⶨNa2CO3��NaCl�������Na2CO3��������ʵ�顣
���飺��������������������ƽ��ȡw�˻�����ܽ�������ˮ�������CaCl2��Ȼ�����ó������ˡ�ϴ�ӡ����������m�ˣ�д���÷�Ӧ�����ӷ���ʽ________________________����������Na2CO3����������Ϊ��д������ʽ����___________��
���飺�������������һ�����Ļ�������������ᷴӦ������ͼװ�òⶨ������CO2����������Ϊ��СCO2���ܽ⣬B����ҺӦ��_______��

A������������Һ B������̼������Һ C������̼��������Һ
ѡ�ø���Һ��ʵ�������Dz�ȷ��ԭ����_____________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪1molȼ����ȫȼ�յ����ݷֱ�Ϊ��
ȼ�� | һ����̼ | ���� | �����飨C8H18�� | �Ҵ� |
��H | ��283.0kJmol��1 | ��891.0kJmol��1 | ��5461.0kJmol��1 | ��1366.8kJmol��1 |
ʹ������ȼ�ϣ��������֡���̼���á�������ǣ� ��
A.һ����̼
B.����
C.������
D.�Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ���ۻ�����һ���������Ӽ�
B. ���ӻ�����һ���������ۼ�
C. ��̬���ʵķ�����һ�����ڹ��ۼ�
D. ȫ���ɷǽ���Ԫ���γɵĻ�����һ���������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1mol̼��ȫȼ�պ�ɷų�393.5KJ�������������Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A.C��s��+O2��g��=CO2��g����H=+393.5 kJ/mol
B.C��s��+ ![]() O2��g��=CO��g����H=��393.5 kJ/mol
O2��g��=CO��g����H=��393.5 kJ/mol
C.C+O2=CO2��H=��393.5 kJ/mol
D.C��s��+O2��g��=CO2��g����H=��393.5 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ����ֱ�۵ط�ӳ�й��������ı仯�����ɣ����и�ͼ��������������ǣ� ��
A. ��ͼ��ʾSO2������Ӧ�ֱ����С�����������·�Ӧ�����е������仯
��ͼ��ʾSO2������Ӧ�ֱ����С�����������·�Ӧ�����е������仯
B. ��ͼ��ʾ0.1molMgCl26H2O�ڿ����г�ּ���ʱ����������ʱ��ı仯
��ͼ��ʾ0.1molMgCl26H2O�ڿ����г�ּ���ʱ����������ʱ��ı仯
C. ��ͼ��ʾ�ֱ�ϡ��1mLpH=2������ʹ���ʱ��ҺpH�ı仯��ͼ��b��100mL
��ͼ��ʾ�ֱ�ϡ��1mLpH=2������ʹ���ʱ��ҺpH�ı仯��ͼ��b��100mL
D.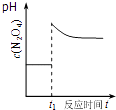 ��ͼ��ʾƽ��2NO2��g��N2O4��g����t1ʱѸ�ٽ������С��c��N2O4���ı仯
��ͼ��ʾƽ��2NO2��g��N2O4��g����t1ʱѸ�ٽ������С��c��N2O4���ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ױ��������Ʊ�������ķ�Ӧԭ�����£� 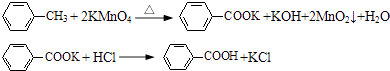
ʵ��ʱ��һ�����ļױ���KMnO4��Һ����ͼ1װ���У���100��ʱ����Ӧһ��ʱ�䣬��ֹͣ��Ӧ�������������̷����������ͻ���δ��Ӧ�ļױ���
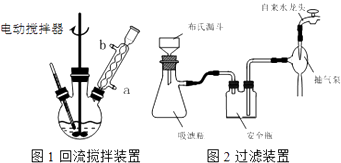
��1��ʵ������ʵ�ֲ���������IJ������������ձ��������������Ϊ ��
��2�������Һ����ɫ��Ҫ�ȼ���������أ�Ȼ���ټ���Ũ�����ữ�����˲�������ֵ�Σ���� ��
��3���ڲ������У�����ǰ�������ȴ��Һ����ԭ��������ͼ2��ʾ������ϣ�Ӧ�ȶϿ���Ƥ�ܣ�
��4�����Ȳⶨ����ȡ1.220g��Ʒ�����100mL��Һ��ȡ����25.00mL��Һ�����еζ�������KOH���ʵ���Ϊ2.4��10��3 mol����Ʒ�б�������������Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com