
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.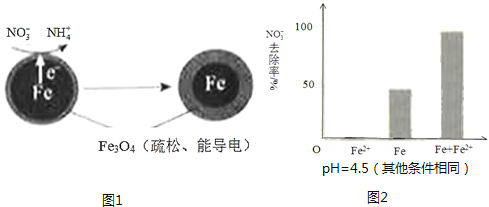
(1)Fe还原水体中NO3﹣的反应原理如图1所示.
①作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .
【答案】
(1)铁;NO3﹣+8e﹣+7H2O=NH4++10OH﹣
(2)pH越高,Fe3+越易水解生成FeO(OH),FeO(OH)不导电,所以NO3﹣的去除率低
(3)Ⅱ;Fe2++2FeO(OH)=Fe3O4+2H+ , 加入Fe2+之所以可以提高硝酸根离子的转化率主要因为减少了FeO(OH)的生成,增强了导电性,另外生成了H+ , H+浓度增大,pH减小,使NO3﹣的转化率增大
(4)由于Fe3+的水解,所以pH越高,Fe3+越容易生成FeO(OH),FeO(OH)又不导电,所以NO3﹣的去除率越低
【解析】解:(1)①Fe还原水体中NO3﹣ , 则Fe作还原剂,失去电子,作负极,
故答案为:铁;
②NO3﹣在正极得电子发生还原反应产生NH4+ , 根据电荷守恒写出离子方程式:NO3﹣+8e﹣+7H2O=NH4++10OH﹣ ,
故答案为:NO3﹣+8e﹣+7H2O=NH4++10OH﹣;
(2)pH越高,Fe3+越易水解生成FeO(OH),FeO(OH)不导电,所以NO3﹣的去除率低,
故答案为:pH越高,Fe3+越易水解生成FeO(OH),FeO(OH)不导电,所以NO3﹣的去除率低;
(3)①从右图可以看出只加入铁粉和只加入Fe2+ , NO3﹣的去除率都不及同时加入铁和亚铁离子时NO3﹣的去除率高,说明不是应用了亚铁离子的还原性提高硝酸根的去除率,而是由于Fe2+破坏FeO(OH)氧化层,
故答案为:Ⅱ;
②同位素示踪法证实了Fe2+能与FeO(OH)反应生成Fe3O4 , 离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+ , 加入Fe2+之所以可以提高硝酸根离子的转化率主要因为减少了FeO(OH)的生成,增强了导电性,另外生成了H+ , H+浓度增大,pH减小,使NO3﹣的转化率增大,
故答案为:Fe2++2FeO(OH)=Fe3O4+2H+ , 加入Fe2+之所以可以提高硝酸根离子的转化率主要因为减少了FeO(OH)的生成,增强了导电性,另外生成了H+ , H+浓度增大,pH减小,使NO3﹣的转化率增大;
(4)由于Fe3+的水解,所以pH越高,Fe3+越容易生成FeO(OH),FeO(OH)又不导电,所以NO3﹣的去除率越低,
故答案为:由于Fe3+的水解,所以pH越高,Fe3+越容易生成FeO(OH),FeO(OH)又不导电,所以NO3﹣的去除率越低.
(1)①Fe还原水体中NO3﹣ , 则Fe作还原剂,失去电子,作负极;②NO3﹣在正极得电子发生还原反应产生NH4+;
(2)pH越高,Fe3+越易水解生成FeO(OH),FeO(OH)不导电,所以NO3﹣的去除率低;
(3)①从右图可以看出只加入铁粉和只加入Fe2+ , NO3﹣的去除率都不及同时加入铁和亚铁离子时NO3﹣的去除率高,说明不是应用了亚铁离子的还原性提高硝酸根的去除率;②同位素示踪法证实了Fe2+能与FeO(OH)反应生成Fe3O4 , 离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+ , 既减少了FeO(OH)的生成,增强了导电性,又生成了H+ , H+浓度增大,pH减小,使NO3﹣的转化率增大;
(4)由于Fe3+的水解,所以pH越高,Fe3+越容易生成FeO(OH),FeO(OH)又不导电,所以NO3﹣的去除率越低.考查化学反应原理,涉及到的知识有电化学、氧化还原反应等,题中的Fe与NO3﹣的反应跟溶液酸碱性有关,抓住这一点是解题的关键,第Ⅱ问的解答有一定的难度,特别是阐述上的准确性.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有下列高聚物:A.聚乙烯 B.天然橡 C.硫化橡胶 D.酚醛树脂E.有机玻璃(聚甲基丙烯酸甲酯)
其中属于线型结构的是 , 属于体型结构的是 , 加热可熔融的是 , 用于制备轮胎的是 , 用于制备插座、电器把手的是 , 用于制造车窗玻璃的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.
(1)还原沉淀法是处理含Cr2O72﹣和CrO42﹣工业废水的一种常用方法,其工艺流程为:CrO42﹣ ![]() Cr2O72﹣
Cr2O72﹣ ![]() Cr3+
Cr3+ ![]() Cr(OH)3↓
Cr(OH)3↓
其中第Ⅰ步存在平衡:
2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O
①若平衡体系的pH=0,该溶液显色.
②根据2CrO42﹣+2H+Cr2O72﹣+H2O,设计如右图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7 . Na2Cr2O7中铬元素的化合价为 , 图中右侧电极连接电源的极,其电极反应式为 .
③第Ⅱ步反应的离子方程式: .
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火.若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3 . 完成该反应的化学方程式:
□CrO3+□C2H5OH+□H2SO4═□Cr2(SO4)3+□CH3COOH+□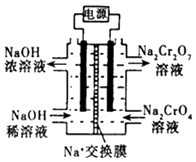
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用.其工作流程如下: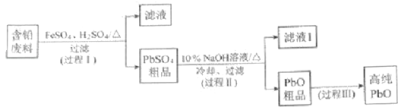
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是 .
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++SO42﹣═2Fe3++PbSO4+2H2O
ii:…
①写出ii的离子方程式: .
②下列实验方案可证实上述催化过程.将实验方案补充完整.
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2 , 溶液变红.
b. .
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)NaHPbO2(aq),其溶解度曲线如图所示.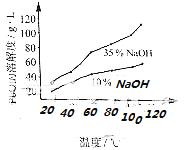
①过程Ⅱ的目的是脱硫.滤液1经处理后可在过程Ⅱ中重复使用,其目的是(选填序号).
A.减小Pb的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过程Ⅲ的目的是提纯,结合上述溶解度曲线,简述过程Ⅲ的操作:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四块金属片,用导线两两相连插入稀硫酸中,可以组成各种原电池。若A和B相连时,A为负极;C与D相连时,C溶解,D上有氢气生成;A与C相连时,C为正极;B与D相连时,电子由D极经导线流向B极,则这四种金属的活泼性由强到弱的顺序为( )
A. ABCDB. ACDBC. CADBD. BDCA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于正在研究和开发的新能源有( )
①生物质能 ②柴草 ③煤炭 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气.
A.①④⑤
B.②③⑥⑦
C.③⑥⑦⑧
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的类型说法正确的是( )
A. HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
B. 非金属元素组成的化合物中只含共价键
C. H与O、H与N均可形成既含极性共价键又含非极性共价键的化合物
D. NaHCO3和HCOONa都只含离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com