
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用.其工作流程如下: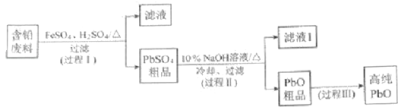
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是 .
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++SO42﹣═2Fe3++PbSO4+2H2O
ii:…
①写出ii的离子方程式: .
②下列实验方案可证实上述催化过程.将实验方案补充完整.
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2 , 溶液变红.
b. .
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)NaHPbO2(aq),其溶解度曲线如图所示.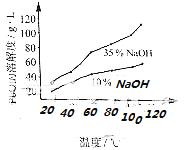
①过程Ⅱ的目的是脱硫.滤液1经处理后可在过程Ⅱ中重复使用,其目的是(选填序号).
A.减小Pb的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过程Ⅲ的目的是提纯,结合上述溶解度曲线,简述过程Ⅲ的操作:
【答案】
(1)Pb+PbO2+2H2SO4═2PbSO4+2H2O
(2)2Fe3++Pb+SO42﹣═PbSO4+2Fe2+;取a中红色溶液少量,加入过量Pb,充分反应后,红色褪去
(3)A;粗PbO溶解在35%NaOH溶液中配成高温下的饱和溶液,冷却结晶、过滤得PbO
【解析】(1)根据题给化学工艺流程知,过程Ⅰ中,在Fe2+催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,所以答案是:Pb+PbO2+2H2SO4═2PbSO4+2H2O;(2)①催化剂通过参加反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后保持不变.根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+ , 则反应ii中Fe3+被Pb还原为Fe2+ , 所以答案是:2Fe3++Pb+SO42﹣═PbSO4+2Fe2+;
②a实验证明发生反应i,则b实验需证明发生反应ii,实验方案为:
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2 , 溶液变红,亚铁离子被氧化为铁离子。
b.溶液中存在平衡,Fe3++3SCN﹣=Fe(SCN)3 , 加入过量Pb,和平衡状态下铁离子反应生成亚铁离子,平衡逆向进行充分反应后,红色褪去,
所以答案是:取a中红色溶液少量,加入过量Pb,充分反应后,红色褪去;(3)①过程Ⅱ脱硫过程中发生的反应为PbSO4+2NaOH=PbO+Na2SO4+H2O,而滤液Ⅰ中含有硫酸,可降低溶液的PH,使平衡PbO(s)+NaOH(aq)NaHPbO2(aq)逆向移动,减少PbO损失,提高产品的产率,所以答案是:A;
②根据PbO的溶解度曲线,提纯粗Pb的方法为将粗PbO溶解在35%NaOH溶液中配成高温下的饱和溶液,冷却结晶、过滤得到PbO,
所以答案是:粗PbO溶解在35%NaOH溶液中配成高温下的饱和溶液,冷却结晶、过滤得PbO;


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】CoCl26H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3 , 还含少量Fe2O3、Al2O3、MnO等)制取CoCl26H2O的工艺流程如图1: 
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式 .
(2)写出NaClO3发生反应的主要离子方程式;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 .
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 .
(4)“操作1”中包含3个基本实验操作,它们依次是、和过滤.制得的CoCl26H2O在烘干时需减压烘干的原因是 .
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是;其使用的最佳pH范围是 . A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl26H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl26H2O的质量分数大于100%,其原因可能是 . (答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验.
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;… |
下列对实验现象的解释或推测不合理的是( )
A.a、d处:2H2O+2e﹣═H2↑+2OH﹣
B.b处:2Cl﹣﹣2e﹣═Cl2↑
C.c处发生了反应:Fe﹣2e﹣═Fe2+
D.根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.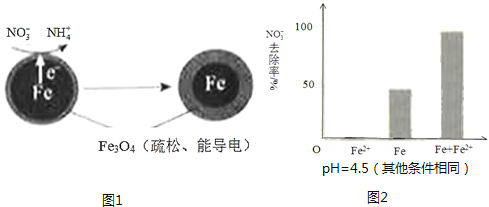
(1)Fe还原水体中NO3﹣的反应原理如图1所示.
①作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,后者最终能被漂白的是
A.将干燥的氯气与红色鲜花充分接触B.将H2O2加入到KMnO4溶液中
C.将足量SO2通入紫色石蕊试液中D.将漂白液加入到Fe2 (SO4)3溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图
和有关信息如下: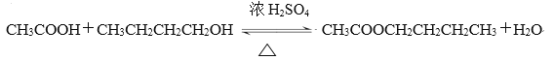
乙酸 | 正丁醇 | 乙酸丁酯 | |
熔点/℃ | 16.6 | -89.5 | -73.5 |
沸点/℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |

(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是。
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是(填标号)。
A.①②③④ B.③①④② C.④①③② D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目是。
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号)。
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8 mL,假设在制取乙酸丁酯过程中反应
物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足下如图物质一步转化关系的选项是( )
X | Y | Z | |
A | Na | NaOH | NaHCO3 |
B | Cu | CuSO4 | Cu(OH)2 |
C | C | CO | CO2 |
D | Si | SiO2 | H2SiO3 |

A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com