
【题目】下列说法正确的是( )
A.盐溶液都是中性的
B.盐溶液的酸碱性与盐的类型无关
C.碳酸钠溶液显碱性,是因为溶液中c(OH﹣)>c(H+)
D.NaHCO3溶液显酸性
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol/LNa2CO3溶液加适量水稀释,下列各项随着加水量的增大而减小的是
A. n(OH-) B. 溶液的pH C. n(H+)·c(OH-) D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某校化学研究性学习小组探究的过量的Fe与浓硫酸反应的实验:
I.甲同学设计如下实验反应得到的混合气体中含有SO2、H2、H2O
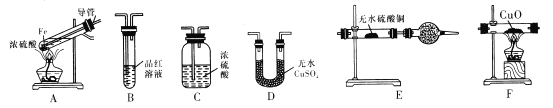
己知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:________。
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→______(不可重复使用)。
(3)A中导管的作用为______,装置E中的干燥管中盛放的物质为碱石灰,其作用是________。
(4)证明有H2存在的实验现象是_________。
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:
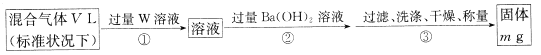
(5) W溶液可以是下列溶液中的______(填字母代号);
A.H2O2溶液 B.NaOH溶液 C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为_______(用含V、m的代数式表示)。
(6)丙同学使用cmol/LxmLI2的淀粉溶液(过量)吸收混合气体,充分反应后,用0.1000mol/L的Na2S2O3标准溶液去滴定I2的淀粉溶液,达到滴定终点时消耗Na2S2O3的体积为20mL,该混合气体中二氧化硫的体积分数为______(用含V、c、x的代数式表示)[已知:I2+2S2O32-=2I-+S4O62-]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四组物质:①从碘的四氯化碳溶液中分离出碘;②从氯化钠和单质溴的水溶液中分离出溴;③含有水份的植物油中除去水份;④分离豆浆和豆渣.分离以上混合物的正确方法依次是( )
A.蒸馏、萃取、分液、过滤
B.萃取、蒸馏、分液、蒸发
C.萃取、蒸馏、分液、过滤
D.蒸馏、萃取、分液、蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸钠(Na2S2O8)具有强氧化性,在印染、造纸和医学等方面应用广泛。利用电解制备过二硫酸钠的装置如图(a、b 均为惰性电极):下列说法正确的是

A. 过二硫酸钠中的硫呈+7价
B. 电极a是电解池的阴极
C. 电极a的电极反应式为:2SO42-+2e-=S2O82-
D. 所用离子交换膜为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,错误的是( )
A.H2CO3H++HCO3﹣; HCO3﹣H++CO32﹣
B.H2SO4═2H++SO42﹣
C.NaHS═Na++H++S2﹣
D.CH3COOHH++CH3COO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能说明元素X的电负性比元素Y的大的是 ( )
A. 与H2化合时X单质比Y单质容易
B. X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强
C. X原子的最外层电子数比Y原子的最外层电子数多
D. X单质可以把Y从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用。其流程图如下。已知FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。

金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
开始沉淀pH | 2.7 | 6.5 | 7.7 | 5.2 | 6.9 |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高浸出率可以采用的方法是(写出其中一点即可)______________。
(2)滤液I中有少量的AsO33-,若不除去,则AsO33-与Cd反应会产生一种有毒氢化物气体,该气体的分子式为_________。向滤液I中逐滴滴人酸性KmnO4溶液可与AsO33-发生反应生成FeAsO4,完成该反应的离子方程式:_________
___Fe2++___AsO33-+___MnO4-+ □= Mn2++ FeAsO4↓+ □,判断该滴定终点的现象是_______。
(3)流程中②调节pH时可以选用的试剂为________,滤渣Ⅱ的主要成份为________。
(4)常温下Zn(OH)2的溶度积Ksp=_____________________。
(5)制得的ZnSO4 7H2O需洗涤,洗涤晶体时应选用试剂为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
A. 配合物中中心原子的电荷数和配位数均为6 B. 该配合物可能是平面正方形结构
C. Cl-和NH3分子均与Pt4+配位 D. 配合物中Cl-与Pt4+配位,而NH3分子不配位
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com