
【题目】利用苯甲醛(C6H5CHO)在NaOH溶液中可以制苯甲醇(C6H5CH2OH)和苯甲酸(C6H5COOH)。实验流程如图:
相关物质的性质如下表所示。回答下列问题:
物质 | 对水的相对密度 | 沸点 | 溶解性 |
苯甲醇 | 1.04 | 205.7 | 微溶于水,易溶于乙醚 |
苯甲酸 | 1.27 | 249 | 微溶于冷水,可溶于热水,易溶于乙醚 |
乙醚 | 0.71 | 34.6 | 与水互不相溶 |
(1)操作①中,需要用到的玻璃仪器除烧杯外,还有____。操作①后,苯甲醇在容器中混合物的_____(填“上”或“下”)层。
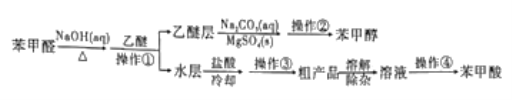
(2)乙醚层用10%Na2CO3溶液洗涤的目的是_____。操作②前常需要加入MgSO4,作用是______。操作②的装置如图,指出该装置图中两个错误:______。
(3)操作③是______,操作④是______。
(4)取106.00g苯甲醛反应,若苯甲醛的转化率为80%,乙醚的萃取率为100%,洗涤等过程损失率为10%,则最终可制得苯甲醇___g(结果保留小数点后两位)。
【答案】分液漏斗 上 除去乙醚中溶解的少量苯甲酸 除水 温度计的水银球在液面以下,冷却水上进下出 过滤 蒸发浓缩、冷却结晶 38.88
【解析】
(1)根据流程,操作①得到乙醚层和水层,即该操作步骤为分液,分液时需要的仪器是带铁圈的铁架台、烧杯、分液漏斗,因此缺少的玻璃仪器是分液漏斗;根据表格的数据,乙醚的密度小于水的密度,以及苯甲醇易溶于乙醚,即苯甲醇在容器中混合物的上层;
答案为分液漏斗;上层;
(2)苯甲醛与NaOH溶液反应的方程式为2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa,苯甲酸钠发生水解,生成少量的苯甲酸,根据表格,苯甲酸易溶于乙醚,即乙醚层中溶有少量的苯甲酸,因此用Na2CO3洗涤的目的是除去乙醚中溶解的少量苯甲酸;MgSO4具有吸水性,因此加入MgSO4的目的是除去乙醚层中的水;该装置为蒸馏装置,错误出:一是温度计水银球在液面以下,应在支管口略低处;二是冷却水的进水和出水方向错误,应是下进上出;
答案是除去乙醚中溶解的少量苯甲酸;除水;温度计的水银球在液面以下,冷却水上进下出;
(3)水层中含有苯甲酸钠,加入盐酸发生C6H5COONa+HCl→C6H5COOH+NaCl,因为苯甲酸微溶于冷水,冷却后,苯甲酸固体析出,即操作③为过滤;操作④是从溶液中得到苯甲酸,因此操作④是蒸发浓缩、冷却结晶;
答案是过滤;蒸发浓缩、冷却结晶;
(4)苯甲醛与NaOH溶液反应的方程式为2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa,C6H5CONa+HCl→C6H5COOH+NaCl,最终制得苯甲醇的质量为![]() =38.88g;
=38.88g;
答案是38.88g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图是合成氨反应的正、逆反应速率随反应时间变化的示图,有关叙述错误的是
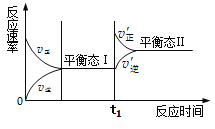
A. 状态Ⅰ和状态Ⅱ时,反应均处于平衡状态
B. 状态Ⅰ变化为状态Ⅱ的过程,称为化学平衡移动
C. t1时刻平衡向正反应方向移动,平衡常数增大
D. 同一种反应物在状态I和状态II时,浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:Ⅰ.RCOOR′+ R′′18OH![]() RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
Ⅱ. (R、R′代表烃基);
(R、R′代表烃基);
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n 或C10n+2H8n+6O4n+2)并生成B的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. MnO2![]() Cl2
Cl2![]() SiCl4
SiCl4
B. Ca(ClO)2![]() HClO
HClO![]() HCl
HCl
C. 浓H2SO4![]() SO2
SO2![]() BaSO4
BaSO4
D. SiO2(s)![]() H2SiO3(胶体)
H2SiO3(胶体)![]() Na2SiO3(aq)
Na2SiO3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法不正确的是
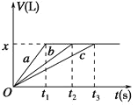
A. x=2.24
B. 三种金属的物质的量均为0.2 mol
C. 反应时,Na、Mg、Al均过量
D. 曲线b为Mg与盐酸反应的图象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是严重的大气污染物,能引起雾霾、光化学烟雾、酸雨等环境问题。回答下列问题
(1)利用甲烷催化可还原NOx,相关反应如下
N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l) △H=-1160kJ·mol-1
写出常温常压下,甲烷完全燃烧的热化学方程式:_______。
(2)在催化剂条件下,可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g)。分别在T1、T2两个温度下,向容积均为2L的甲、乙两个恒容密闭容器中分別充入0.20 mol NO(g)和0.20 mol CO(g)。反应过程中两容器中CO2的物质的量浓度随时间的变化关系如图所示。
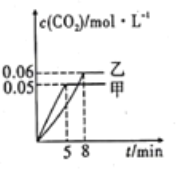
①甲容器中,用NO表示5min内反应速率为_____。
②T1___(填“>”或“<”)T2,该反应是_____(填“吸热”或“放热”)反应。
③T2温度时,该反应的平衡常数是_____L/mol(结果保留小数点后两位),与T2时相比,T1温度时的平衡常数更___(填“大”或“小”)。
④乙容器达到平衡后,再充入0.10mlNO和0.10molCO2,此时υ(正)___(填“>”或“<”)v(逆)。
(3)NO2和NO的混合物可被NaOH吸收生成 NaNO2。已知HNO2是一元弱酸,写出NaNO2溶液中离子浓度的大小关系:___。常温下,pH=9的NaNO2溶液中,c(Na+)—c(NO2-)=_______(列出数学计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g);
2SO3(g); ![]() 。实验测得起始、平衡时的有关数据如下表:
。实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是 ( )
A.Q1=Q2=Q3="197" kJ
B.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A. 0.1(b-2a)mol/LB. 10(2a-b)mol/LC. 10(b-a)mol/LD. 10(b-2a)mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com