
氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
Ⅰ.(1)N2H4中的N原子最外层达到8电子稳定结构,写出N2H4的结构式_____________。
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 。
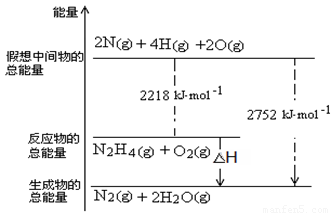
(3)肼是一种高能燃料,有关化学反应的能量变化如右图所示,写出肼燃烧的热化学方程式 。
Ⅱ.氨的合成是最重要的化工生产之一。已知:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1
2NH3(g)ΔH=-92.4 kJ·mol-1
在3个体积均为2L的密闭容器中,在相同的温度下,使用相同的催化剂合成氨,实验测得反应在起始、达到平衡时的有关数据如下表所示:

试回答:
(1)下列各项能说明该反应已达到平衡状态的是______________(填写序号字母)。
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)分析上表数据,下列关系正确的是_________(填写序号字母)。
A.2c1>1.5mol·L-1 B.w3=w1 C.2ρ1=ρ2 D.K甲= K乙= K丙
(3)容器乙中反应从开始到达平衡平均速率为v(H2)= _____________。
III.直接供氨式碱性燃料电池的电池反应式是4NH3+3O2=2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是__________ 。
Ⅰ.(1) (1分)
(1分)
(2) 2NH3+NaClO=N2 H4+NaCl+H2O(2分)
(3)N2 H4(g) + O2(g) = N2(g) + 2H2O(g ) ΔH=-534 kJ·mol-1(2分)
Ⅱ.(1)C(2分)
(2)A C D(3分)
(3)0.3 mol·L-1·min-1(2分)
III.2NH3 + 6OH- + 6e- = N2 + 6H2O(2分)
【解析】
试题分析:Ⅰ.(1)N2H4中的N原子可达到8电子的稳定结构,氮原子最外层3个电子形成三对共用电子对,和未成键的一对电子形成8电子稳定结构,每个氮原子和两个氢原子形成共价键,氮原子间形成一个共价键,结构式为: ,故答案为:
,故答案为: ;
;
⑵NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为:2NH3+NaClO=N2 H4+NaCl+H2O,答案:2NH3+NaClO=N2 H4+NaCl+H2O;⑶从图中读出,△H=22218kJ·mol-1-2752kJ·mol-1=-534 kJ·mol-1,所以肼燃烧生成气态水的热化学方程式为:N2 H4(g) + O2(g) = N2(g) + 2H2O(g ) ΔH=-534 kJ·mol-1,答案:N2 H4(g) + O2(g) = N2(g) + 2H2O(g ) ΔH=-534 kJ·mol-1;
Ⅱ.⑴A、应用速率之比来判断,反应过程中按照比例进行反应,故A不能判断该反应达到化学平衡状态;B、按照速率之比等于系数之比,表述的是正反应速率,当某种物质的正反应速率和逆反应速率相等是表明反应达到平衡,所以当3v(N2)正=v(H2)逆 时反应达到平衡,故B不能判断该反应达到化学平衡状态;C、当容器内压强保持不变,说明反应达到平衡,故C能判断该反应达到化学平衡状态;反应体系内质量守恒,体积一定,故混合气体的密度不变,所以混合气体的密度保持不变,不能说明反应达到平衡,故D不能判断该反应达到化学平衡状态;答案:C。
⑵A、正确,先用1.5L的容器进立与乙等效平衡,然后放大到3L,平衡向生成N2的方向即逆方向移动,所以2c1>1.5 mol·L ―1; B、不正确,丙等效于3molH2,1molN2从正确向建立平衡,甲多加了1molN2,平衡正向移动;C、正确,反应体系内质量守恒,体积一定,混合气体的总质量甲是乙的2倍,所以混合气体的密度,2ρ1=ρ2;D、正确,温度不变,平衡常数不变,K甲= K乙= K丙。答案:A C D。
⑶v(H2)=
3v(N2)= ,答案:0.3 mol·L-1·min-1;
,答案:0.3 mol·L-1·min-1;
III.NH3作还原剂,生成1molN2失去6mol电子,用OH― 调节使方程式两边电荷守恒,负极反应,2NH3 + 6OH- + 6e- = N2 + 6H2O,答案:2NH3 + 6OH- + 6e- = N2 + 6H2O
考点:化学平衡的计算;化学平衡状态的判断


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:阅读理解
 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| 1 |
| 2 |
| 3 |
| 2 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| C4(NO)C6(H2O) |
| C4(NH3)C5(O2) |
| 催化剂 |
| 高温高压 |
| 容器 编号 |
起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | △H1=-23.1 |
| B | 0.9 | 2.7 | 0.2 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| 高温 |
| ||
| 高温 |
| 4 |
| 7 |
| ||
| 高温 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| T/K | 298 | 398 | 498 |
| 平衡常数K | 2.44ⅹ10-6 | K1 | K2 |
| 9 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/(K) | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 催化剂 |
| 高温高压 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com