
利用下图所示装置(电极均为惰性电极)可吸收SO2,并制取硫酸和烧碱溶液,下列说法正确的是

A.a电极反应式:SO2 + 2H2O - 2e- == SO42- + 4H+
B.b极与电源的正极相连
C.离子交换膜c为阳离子交换膜
D.气体W为氧气
A
【解析】
试题分析:A.根据图示可知,在a电极上溶液在通入的SO2被氧化为H2SO4,a电子为阳极,电极反应式:SO2 + 2H2O - 2e- == SO42- + 4H+,正确;B.b极为阴极,与电源的负极相连,错误;C.b电极为阴极,在该电极上发生反应:2H++2e-=H2↑;在之间加入的Na2SO4溶液中的SO42-不断通过交换膜进入阳极室,,所以离子交换膜c为阴离子交换膜,Na+不断通过交换膜d进入阴极室,所以交换膜d为阳离子交换膜,错误;D.通过C选项方向可知气体W为氢气,错误。
考点:考查电解原理在制取硫酸和烧碱溶液的应用的知识。
考点分析: 考点1:电解池 试题属性

科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考试理综化学试卷(解析版) 题型:实验题
Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:
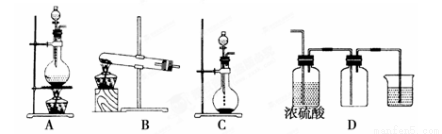
(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为 。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是___________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中在D装置中连接小烧杯的目的是____________________。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(1)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;
(2)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
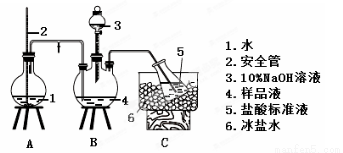
氨的测定装置(已省略加热和夹持装置)
①装置中安全管的作用原理是__________________________________________。
②样品中氨的质量分数表达式为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
(16分)CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体,下列装置可用于CO2气体的提纯和干燥。

完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol·L-1),需要的玻璃仪器有 。
(2)上述装置中,A是 溶液,其作用是 。
(3)上述装置中,B物质是 。
(4)一次性饭盒中石蜡和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重 → 浸泡溶解 → 过滤 → 残渣烘干 → 冷却、称重 → 恒重
①从物质分类的角度分析,石蜡属于有机物中的 类,为了将石蜡从饭盒中溶出,应选用下列试剂中的 。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正已烷
②饭盒中的碳酸钙常用稀醋酸将其溶出,试写出其反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省、广雅中学、佛山一中高三联考理综化学试卷(解析版) 题型:选择题
H2C2O4是一种二元弱酸,NaHC2O4溶液显酸性。现测得某溶液中存在的离子有C2O42-、HC2O4-、OH-、Na+、H+。下列判断正确的是
A.该溶液的溶质只能是Na2C2O4或NaHC2O4或两者的混合物
B.该溶液可能显酸性、碱性或中性
C.溶液中一定存在c(Na+) > c(HC2O4- )
D.溶液中一定存在c(H+) - c(OH-) > c(HC2O4- ) - c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:实验题
(16分)某兴趣小组利用以下实验装置模拟工业炼铁的主要过程:

(1)装置甲中发生的反应为:HCOOH(甲酸) CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该 (填字母)。
CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该 (填字母)。
a.将甲酸滴入浓硫酸 b.将浓硫酸滴入甲酸 c.将甲酸与浓硫酸混合后加入
(2)请按合适的顺序连接好以下装置:甲→( )→( )→( )
(3)丙装置中碱石灰的作用是 。
(4)实验将近完成时,熄灭装置甲、乙、丁中酒精灯的先后顺序为 。
(5)为了探究影响反应产物的外界因素,在Fe2O3,与CO反应部位,该小组同学分别用酒精灯和酒精喷灯进行了两次实验,结果如下:
加热方式 | 通CO加热 时间/min | 澄清石灰水变 浑浊时间/min | 产物颜色 | 产物能否全部 被磁铁吸引 |
酒精灯 | 30 | 5 | 黑色 | 能 |
酒精喷灯 | 30 | 1 | 黑色 | 能 |
①甲同学猜想黑色产物中可能含有碳单质。乙同学排除了该可能,他提出的两种理由是: 、 。
②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:i.全部为铁;ii. ;iii. 。
③通过进一步定量实验,黑色产物所含元素组成和质量分数如下:
样品序号 | 加热方式 | 元素组成和质量分数 |
产物样品I | 酒精灯 | w(Fe)=74.4%、w(O)=25.6% |
产物样品II | 酒精喷灯 | w(Fe)=100% |
样品I的成分及质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
下列实验装置进行相应的实验,能达到实验目的的是
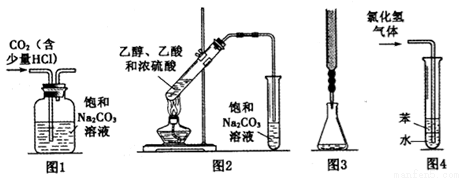
A.图1装置:除去二氧化碳中的少量氯化氢气体
B.图2装置:加热乙醇、乙酸和浓硫酸的混合液制取乙酸乙酯
C.图3装置:用酸性高锰酸钾溶液滴定过氧化氢溶液
D.图4装置:用水吸收氯化氢气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
下列化学用语或模型表示正确的是
A.钠离子的结构示意图:
B.CO2分子的比例模型:
C.乙醇分子的结构简式:CH3CH2OH
D.中子数为2的氢原子符号:12H
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三下学期一模考试理综化学试卷(解析版) 题型:实验题
(20分)氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如下图所示的装置。

(1)若分液漏斗中氨水的浓度为9.0mol·L-1,配制该浓度的氨水100mL,用到的玻璃仪器有100mL容量瓶、烧杯、玻璃棒、 。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的名称为 。
(3)乙装置的作用是 ;写出受热时丙装置发生反应的化学方程式为 。
(4)当戊中观察到 现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因 。如何改进装置 。
(5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是 ;为测定试管丁内硝酸溶液的浓度,从中取10mL溶液于锥形瓶中,用0.1 mol·L-1的NaOH溶液滴定。滴定前发现滴定管尖嘴处有少量气泡,请选择排出气泡的正确操作是 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高三第三次四校联考理综化学试卷(解析版) 题型:填空题
(14分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
温度(K) | 平衡时NH3的物质的量(mol) |
T1 | 2.4 |
T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。

(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。

①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com