
下列实验装置进行相应的实验,能达到实验目的的是
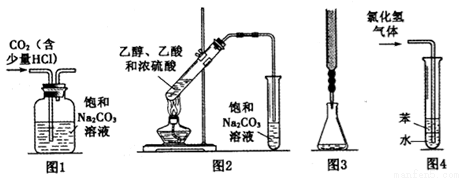
A.图1装置:除去二氧化碳中的少量氯化氢气体
B.图2装置:加热乙醇、乙酸和浓硫酸的混合液制取乙酸乙酯
C.图3装置:用酸性高锰酸钾溶液滴定过氧化氢溶液
D.图4装置:用水吸收氯化氢气体
B
【解析】
试题分析:A.HCl会与Na2CO3发生反应,但是CO2与Na2CO3在溶液中会发生反应:CO2+Na2CO3+ H2O =2NaHCO3,因此不能用于除去二氧化碳中的少量氯化氢气体,错误;B.加热乙醇、乙酸和浓硫酸的混合液,二者发生反应制取乙酸乙,由于乙醇、乙酸有挥发性,产生的酯和挥发的乙酸、乙醇通过导气管到饱和碳酸钠溶液,乙酸与碳酸钠反应,乙醇溶于水,乙酸乙酯在溶液中的溶解度降低,因此可以达到分离的目的,正确;C.酸性高锰酸钾溶液有强的氧化性,会腐蚀碱式滴定管的橡胶管,因此不能用碱式滴定管盛装酸性高锰酸钾溶液,而应该用酸式滴定管,错误;D.用该装置若用水吸收氯化氢气体,会产生倒吸现象,应该用CCl4溶液和水,这样就可以防止倒吸现象的发生,也可以充分吸收HCl气体。错误。
考点:考查化学实验装置的操作及实验目的的关系的知识。
考点分析: 考点1:综合性实验 试题属性

科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考试理综化学试卷(解析版) 题型:选择题
某恒温密闭容器中,可逆反应A(s)  B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是
B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是
A.产物B的状态只能为固态或液态
B.平衡时,n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量小于Q kJ
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列关于0.1 mol·L-1 NH4Cl溶液的说法正确的是
A.向溶液中加滴加几滴浓盐酸,c(NH4+)减少
B.向溶液中加入少量CH3COONa固体,c(NH4+)减少
C.溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.向溶液中加适量氨水使混合液的pH=7,混合液中c(NH4+)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省、广雅中学、佛山一中高三联考理综化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法不正确的是
A.1L 0.1 mol·L-1NH4NO3溶液中含有0.1nA个NO3-
B.常温常压下,2.2g 14CD4含有nA个质子
C.常温下,将1 mol Fe投入足量浓硝酸中,转移3nA个电子
D.标准状况下,11.2L的CO和N2的混合气体含有nA个原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
利用下图所示装置(电极均为惰性电极)可吸收SO2,并制取硫酸和烧碱溶液,下列说法正确的是

A.a电极反应式:SO2 + 2H2O - 2e- == SO42- + 4H+
B.b极与电源的正极相连
C.离子交换膜c为阳离子交换膜
D.气体W为氧气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
若NA表示阿伏加德罗常数,下列叙述正确的是
A.1 L 0.1 mol·L-1氨水中含有0.1 NA个OH-
B.1 mol SO2和CO2的混合气体中含有2NA个氧原子
C.1 mol—OH (羟基) 与l mol OH-均含有10个NA e-
D.在标准状况下,22.4 L四氯化碳中含有NA个分子
查看答案和解析>>
科目:高中化学 来源:2015年期中备考总动员高三化学模拟卷【福建】3(解析版) 题型:简答题
(15分)氯化亚铜(CuCl)是一种白色固体,微溶于水,不溶于酒精。研究该物质的应用新领域、生产新方法及生产过程中的环保新措施都具有重要意义。
(1)镁—氯化亚铜海水电池,可用于鱼雷上。该电池被海水激活时,正极导电能力增强,同时产生气泡,则正极上被还原的物质有 、 (填化学式)。
(2)工业上以铜作催化剂,氯代甲烷和硅粉反应合成甲基氯硅烷的过程中产生大量废渣(主要成分为硅粉、铜、碳等)。某课外小组以该废渣为原料制CuCl,流程示意图如下:

回答下列问题:
①氯代甲烷有4种,其中属于重要工业溶剂的是 (写出化学式)。
②“还原”阶段,SO32-将Cu2+还原得[CuCl2]-,完成下列离子方程式。
 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ =
= [CuCl2]-+
[CuCl2]-+ +
+
③在稀释过程中存在下列两个平衡:
ⅰ.[CuCl2]- CuCl+Cl- K=2.32
CuCl+Cl- K=2.32
ⅱ.CuCl(s) Cu+(aq)+Cl- Ksp=1.2×10-6
Cu+(aq)+Cl- Ksp=1.2×10-6
当[CuCl2]-完成转化时(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥ 。
④获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常用无水乙醇代替蒸馏水做洗涤剂的优点是 (写一点)。
(3)工业生产CuCl过程中产生浓度为2~3 g·L-1的含铜废水,对人及环境都有较大的危害,必须进行回收利用。用萃取法富集废水中的铜,过程如下:

①实验室完成步骤ⅰ时,依次在分液漏斗中加入曝气后的废水和有机萃取剂,经振荡并 后,置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先 ,然后打开活塞放出下层液体,上层液体从上口倒出。
②写出步骤ⅱ的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三下学期一模考试理综化学试卷(解析版) 题型:选择题
某溶液可能含有Na+、Fe3+、Br﹣、I﹣、HCO3﹣、SO32﹣、NO3﹣等离子①向该溶液中滴加氯水,无气泡产生,溶液呈橙色;②向橙色溶液中加入BaCl2溶液产生白色沉淀;③向橙色溶液中滴加淀粉溶液未变蓝,则在该溶液中肯定存在的离子组是
A.Na+、I﹣、SO32﹣ B.Na+、Br﹣、SO32﹣
C.Fe3+、Br﹣、NO3﹣ D.Na+、Br﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高三第三次四校联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.分子式为C10H12O2的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成气体,满足以上2个条件的该有机物的同分异构体有15种
B.对苯二甲酸( )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维(
)与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维( )
)
C.分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种
D. 分子中的所有原子有可能共平面
分子中的所有原子有可能共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com