
【题目】CuSO4是一种重要的化工原料,其制备途径及性质如图所示(假设恰好完全反应)。下列说法正确的是
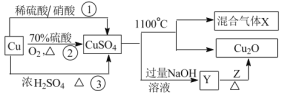
A.途径①所用混酸中,H2SO4与 HNO3物质的量之比为2:3
B.1molCuSO4在 1100℃所得混合气体中,O2为 0.75mol
C.Z 只能是葡萄糖
D.相对于途径①、③,途径②更好地体现了绿色化学思想
【答案】D
【解析】
A项、途径①的反应为铜与稀硝酸、稀硫酸反应生成硫酸铜、一氧化氮和水,反应的化学方程式为3Cu+2HNO3+3 H2SO4=3CuSO4+2NO↑+4H2O,由方程式可知混酸中H2SO4与HNO3物质的量之比最好为3:2,故A错误;
B项、CuSO4在1100℃分解生成氧化亚铜,铜元素化合价降低被还原,硫酸铜中硫元素为最高价态,只能表现氧化性,则氧元素只能被氧化化合价升高,X可能是O2和SO3或O2和SO2或O2、SO2和SO3的混合气体,若X为O2和SO3的混合气体,由得失电子数目守恒可知1molCuSO4在 1100℃所得混合气体中O2为 0.25mol,若X为O2和SO2的混合气体,由得失电子数目守恒可知1molCuSO4在 1100℃所得混合气体中O2为 0.7 5mol,若X为O2、SO2和SO3的混合气体,由得失电子数目守恒可知1molCuSO4在 1100℃所得混合气体中O2介于0.25mol 和0.7 5mol之间,故B错误;
C项、含有醛基的有机物都能与新制的氢氧化铜悬浊液共热反应生成氧化亚铜,故C错误;
D项、途径①有有害气体一氧化氮生成,途径③有有害气体二氧化硫生成,相对于途径①、③,途径②生成等量硫酸铜需要的硫酸少,无有害气体产生,更好地体现了绿色化学思想,故D正确;
故选D。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造。以镍粉废料为原料制备Ni2O3的工艺如下:
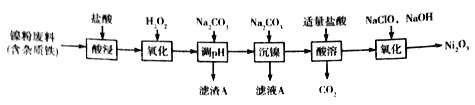
回答下列问题:
(1)Ni2O3中Ni的化合价为_________。
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是__________。
(3)加入H2O2“氧化”的离子方程式为_____________;滤渣A的主要成分是________(填化学式)。
(4)工艺中分步加入Na2CO3的作用是________;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为_________。
(5)工业上,用镍为阳极,电解0.1mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电流效率是指电解时,在电极上实际沉积的物质的量与理论析出量之比)及镍的成粉率的影响如图所示:
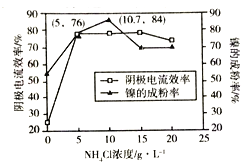
①为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为______mol/L.
②当NH4Cl溶液的浓度大于15g/L时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中加入铝粉能放出氢气,此溶液中一定能大量共存的离子组是( )
A.H+、Cu2+、Cl﹣、![]() B. HCO3-、NO3-、SO42-、Na+
B. HCO3-、NO3-、SO42-、Na+
C.Cl﹣、SO42-、Na+、K+D.Fe3+、SO42-、Cl﹣、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知:
Cu(s) + 2H+(aq) == Cu2+(aq) + H2(g) △H= +64.39kJ/mol
2H2O2(l) == 2H2O(l) + O2 (g) △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)== H2O(l) △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为______
(2)镁铝合金生活中应用广泛。取样品a克,溶于200mL5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围_____,向反应后溶液中加入4mol/L NaOH溶液____mL,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mLO2后,可完全被H2O吸收,无气体剩余。则生成的NO为_________mL;向反应后溶液加足量的NaOH溶液,得到沉淀的质量____________ g。(用含a的代数式表示)
(4)如图所示,A,F为石墨电极,B,E为铁片电极。按要求回答下列问题。
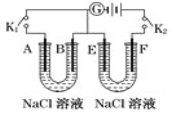
①打开K2,闭合K1,B为____极, A的电极反应式为:_________________________。
②打开K1,闭合K2,E为_____极,F极的电极反应式为:______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
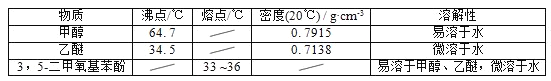
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振氢谱是研究有机物结构的有力手段之一,例如乙醛的结构简式为CH3-CHO,在核磁共振氢谱中有两个峰,其峰面积之比为3:1。
(1)结构式为![]() 的有机物,在核磁共振氢谱上吸收峰的面积之比为 __________;
的有机物,在核磁共振氢谱上吸收峰的面积之比为 __________;
(2)某含氧有机物,其质谱图中最大质荷比为46.0,碳的质量分数为52.2%,氢的质量分数为13.0%,核磁共振氢谱中只有一个吸收峰,则该有机物的相对分子质量为___________,其结构简式是 _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,CPAE是蜂胶的主要活性成分,也可由咖啡酸合成.下列说法不正确的是

A.咖啡酸分子中所有碳原子可能处在同一个平面上
B.1molCPAE与足量的溴水反应,最多消耗3molBr2
C.1mol苯乙醇在O2中完全燃烧,需消耗10molO2
D.1molCPAE与足量的NaOH溶液反应,最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如左图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如右图![]() 下列说法正确的是
下列说法正确的是
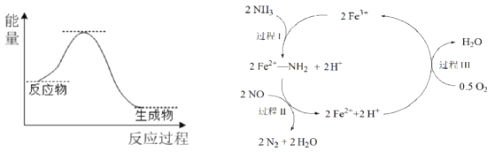
A.NH3催化还原NO为吸热反应
B.过程Ⅰ中NH3断裂离子键
C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂
D.脱硝的总反应为:4NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com