
【题目】铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知:
Cu(s) + 2H+(aq) == Cu2+(aq) + H2(g) △H= +64.39kJ/mol
2H2O2(l) == 2H2O(l) + O2 (g) △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)== H2O(l) △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为______
(2)镁铝合金生活中应用广泛。取样品a克,溶于200mL5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围_____,向反应后溶液中加入4mol/L NaOH溶液____mL,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mLO2后,可完全被H2O吸收,无气体剩余。则生成的NO为_________mL;向反应后溶液加足量的NaOH溶液,得到沉淀的质量____________ g。(用含a的代数式表示)
(4)如图所示,A,F为石墨电极,B,E为铁片电极。按要求回答下列问题。
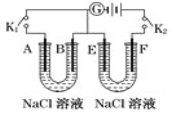
①打开K2,闭合K1,B为____极, A的电极反应式为:_________________________。
②打开K1,闭合K2,E为_____极,F极的电极反应式为:______________________ 。
【答案】Cu(s) +2H+ (aq) + H2O2(l) = Cu2+(aq) + 2H2O(l) △H= -319.68 kJ/mol 2.7<a<3.6 250 89.6 a+0.204 负 O2+4e-+2H2O=4OH- 阴 2Cl--2e-=Cl2↑
【解析】
(1)依据热化学方程式和盖斯定律分析解答;
(2)根据极限法求出极限点,当氢气的量一定时,合金全为Mg时合金质量最大,当合金全为Al时合金质量最小;当沉淀质量达到最大值时,溶液中只有氯化钠溶质,据此分析计算;
(3)根据方程式4NO + 3O2 + 2H2O =4HNO3,求出反应生成的NO的量;向反应后溶液加足量的NaOH溶液,反应后,体系中含有硝酸钠和氢氧化钠溶液,氢氧化铁和氢氧化铜沉淀,结合的氢氧根离子的物质的量与反应过程中转移的电子相等,据此分析计算沉淀的质量;
(4)①当打开K2,闭合K1时,铁片、石墨和NaCl溶液构成原电池,据此分析解答;②当打开K1,闭合K2时,铁片、石墨和NaCl溶液构成电解池,据此分析解答。
(1)①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol,②2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ/mol,③H2(g)+ ![]() O2(g)=H2O(l) △H=-285.84kJ/mol,依据盖斯定律①+
O2(g)=H2O(l) △H=-285.84kJ/mol,依据盖斯定律①+![]() ②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=(+64.39kJ/mol)+(-196.46kJ/mol)×
②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=(+64.39kJ/mol)+(-196.46kJ/mol)×![]() +(-285.84kJ/mol)=-319.6kJ/mol,故答案为:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.6kJ/mol;
+(-285.84kJ/mol)=-319.6kJ/mol,故答案为:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.6kJ/mol;
(2)标况下3.36L氢气物质的量为![]() =0.15mol,则反应的氢离子的物质的量为0.15×2=0.3mol,HCl溶液中HCl物质的量为0.2L×5mol/L=1mol,则盐酸未完全反应。根据Mg和Al与盐酸的反应可知,当氢气的量一定时,合金全为Mg时合金质量最大,全为Al时合金质量最小,
=0.15mol,则反应的氢离子的物质的量为0.15×2=0.3mol,HCl溶液中HCl物质的量为0.2L×5mol/L=1mol,则盐酸未完全反应。根据Mg和Al与盐酸的反应可知,当氢气的量一定时,合金全为Mg时合金质量最大,全为Al时合金质量最小,
Mg~~~~H2
0.15mol 0.15mol
2Al~~~~3H2
0.1mol 0.15mol
两种状况下合金的质量分别为:Mg:0.15mol×24g/mol=3.6g,Al:0.1mol×24g/mol=2.7g,即a的取值范围为2.7<a<3.6;向反应后溶液中加入4mol/L NaOH溶液,当沉淀质量达到最大值时,溶液中只有氯化钠溶质,则氢氧化钠与盐酸的物质的量相等,因此V(NaOH)=![]() =0.25L=250mL,故答案为:2.7<a<3.6;250;
=0.25L=250mL,故答案为:2.7<a<3.6;250;
(3)标准状况下,67.2mLO2的物质的量=![]() =0.003mol,根据方程式4NO + 3O2 + 2H2O =4HNO3,反应生成的NO的物质的量为0.004mol,在标准状况下的体积=0.004mol×22.4L/mol=0.0896L=89.6mL;向反应后溶液加足量的NaOH溶液,反应后,体系中含有硝酸钠和氢氧化钠溶液,氢氧化铁和氢氧化铜沉淀,结合的氢氧根离子的物质的量与反应过程中转移的电子相等,则n(OH-)=3n(NO)=3×0.004mol=0.012mol,因此沉淀的质量=ag+0.012mol×17g/mol=(a+0.204)g,故答案为:89.6;a+0.204;
=0.003mol,根据方程式4NO + 3O2 + 2H2O =4HNO3,反应生成的NO的物质的量为0.004mol,在标准状况下的体积=0.004mol×22.4L/mol=0.0896L=89.6mL;向反应后溶液加足量的NaOH溶液,反应后,体系中含有硝酸钠和氢氧化钠溶液,氢氧化铁和氢氧化铜沉淀,结合的氢氧根离子的物质的量与反应过程中转移的电子相等,则n(OH-)=3n(NO)=3×0.004mol=0.012mol,因此沉淀的质量=ag+0.012mol×17g/mol=(a+0.204)g,故答案为:89.6;a+0.204;
(4)①当打开K2,闭合K1时,铁片、石墨和NaCl溶液构成原电池,负极为铁,电极反应式为:Fe-2e-═Fe2+,正极为石墨,电极反应式为:O2+4e-+2H2O═4OH-,由于Fe2++2OH-═Fe(OH)2↓,4Fe(OH)2+O2+2H2O═4Fe(OH)3,故答案为:负;O2+4e-+2H2O═4OH-;
②当打开K1,闭合K2时,铁片、石墨和NaCl溶液构成电解池,阴极为铁,电极反应式为:2H++2e-═H2↑,阳极为石墨,电极反应式为:2Cl--2e-═Cl2↑,故答案为:阴;2Cl--2e-═Cl2↑。


科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
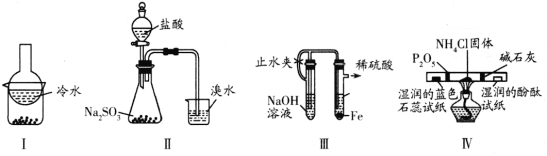
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是

A.用澄清的石灰水可鉴别NaHCO3和Na2CO3
B.溴元素在第③、⑤中被氧化,在第④中被还原
C.工业上一般用金属钠与无水MgCl2反应制取Mg单质
D.海水中还含有碘元素,只需将海水中的碘升华就可以得到碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想利用下图装置(烧瓶位置不能移动)收集下列气体:①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦NO2 ⑧SO2,下列操作正确的是( )

A.在烧瓶中充满水,由A进气收集①③⑤⑦
B.在烧瓶中充满水,由B进气收集⑥
C.烧瓶是干燥的,由A进气收集①③⑤
D.烧瓶是干燥的,由B进气收集②④⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表示正确的是( )
a.体积:②>③>①>④ b.密度:②>③>④>①
c.质量:②>③>①>④ d.氢原子个数:①>③>④>②
A.abcB.bcdC.abcdD.acd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、金属铋生产中,副产品 NaBiO3可作测定锰的氧化剂。工业上常用辉铋矿(主要成分是Bi2S3,还含有少量SiO2等杂质),制备BiOCl和NaBiO3(二者都难溶于水),其流程如下:
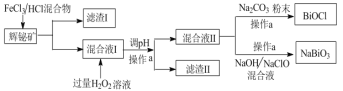
(1)操作a使用的玻璃仪器是_____________,工业上制备HCl的反应原理是:_____。
(2)滤渣I中的成分为________,分离滤渣I中的成分的物理方法是:__________。
(3)请从平衡角度解释调pH产生滤渣Ⅱ的原因:__。
(4)混合液 II 中加入 Na2CO3粉末,当混合液Ⅱ中____________(填实验现象)时,说明BiOCl的生成已完成。混合液II中加入NaOH和NaClO发生的离子方程式________。
(5)加入 H2O2发生反应的离子方程式_______,过滤后,如何洗涤BiOCl固体_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其制备途径及性质如图所示(假设恰好完全反应)。下列说法正确的是
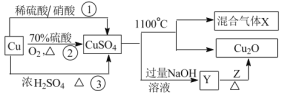
A.途径①所用混酸中,H2SO4与 HNO3物质的量之比为2:3
B.1molCuSO4在 1100℃所得混合气体中,O2为 0.75mol
C.Z 只能是葡萄糖
D.相对于途径①、③,途径②更好地体现了绿色化学思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋为第五周期VA族元素,利用湿法冶金从辉铋矿(含Bi2S3、Bi、Bi2O3等)提取金属铋的工艺流程如下图所示:
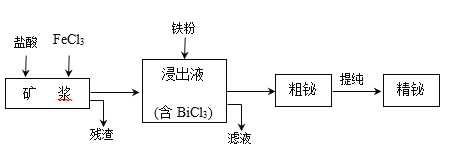
已知:BiCl3水解的离子方程式为:BiCl3+H2O![]() BiOCl+2H++2Cl。
BiOCl+2H++2Cl。
(1)矿浆浸出时加入盐酸的作用是____。
(2)浸出时,Bi溶于FeCl3溶液的化学方程式为____。
(3)残渣中含有一种单质,该单质是_______。
(4)滤液的主要溶质是(化学式)_____,该物质可在工艺中转化为循环利用的原料,转化的反应方程式为____。
(5)精辉铋矿中含有Ag2S,被氧化溶解后不会进入浸出液,银元素以______(填化学式)进入残渣中。
(6)粗铋电解精炼时应放在_______极。
(7)某温度下饱和的Ag2S溶液中,银离子的浓度为10-4mol/L,且Ag2S的KSP=5.8×10-39,则此溶液中硫离子的浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计实验对硫燃烧的产物及其性质进行验证,实验装置如下图所示。
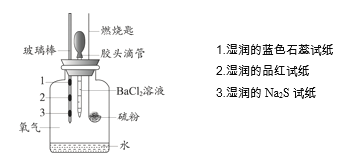
下列实验事实与所得结论相符的是
实验事实 | 所得结论 | |
A | 湿润的品红试纸褪色 | 证明硫燃烧的产物中有SO2 |
B | 湿润的Na2S试纸上出现淡黄色固体 | 证明硫的燃烧产物能被还原成硫 |
C | 湿润的蓝色石蕊试纸变红 | 证明硫的燃烧产物中有酸类物质 |
D | 加入BaCl2溶液产生白色沉淀 | 证明硫燃烧的产物中有SO3 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com