
����Ŀ����Ϊ��������VA��Ԫ�أ�����ʪ��ұ��ӻ����Bi2S3��Bi��Bi2O3�ȣ���ȡ������Ĺ�����������ͼ��ʾ��
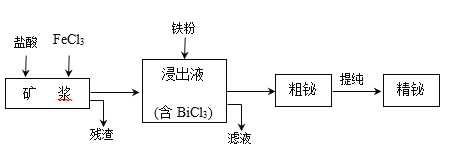
��֪��BiCl3ˮ������ӷ���ʽΪ��BiCl3+H2O![]() BiOCl+2H+��2Cl��
BiOCl+2H+��2Cl��
��1������ʱ���������������____��
��2������ʱ��Bi����FeCl3��Һ�Ļ�ѧ����ʽΪ____��
��3�������к���һ�ֵ��ʣ��õ�����_______��
��4����Һ����Ҫ�����ǣ���ѧʽ��_____�������ʿ��ڹ�����ת��Ϊѭ�����õ�ԭ�ϣ�ת���ķ�Ӧ����ʽΪ____��
��5����������к���Ag2S���������ܽ��������Һ����Ԫ����______���ѧʽ����������С�
��6�������⾫��ʱӦ����_______����
��7��ij�¶��±��͵�Ag2S��Һ�У������ӵ�Ũ��Ϊ10-4mol/L����Ag2S��KSP=5.8��10-39�������Һ�������ӵ�Ũ��Ϊ___________��
���𰸡�Ϊ������BiCl3ˮ�⣬������Ԫ�ص���� Bi+3FeCl3��BiCl3+3FeCl2 S �Ȼ����� 2FeCl2+Cl2��2FeCl3 AgCl �� 5.8��10-31
��������
��1�����к�Bi2S3������FeCl3��Һ���������������ԣ�����������Ϊ���ʣ���ӦΪ��Bi2S3+6FeCl3=2BiCl3+6FeCl2+3S��BiCl3ˮ������ӷ���ʽΪ��BiCl3+H2O![]() BiOCl+2H+��2Cl����ӦҺ���뱣��ǿ���ԣ�������Ԫ�ػ���BiOCl����ʽ�Ȼ��飩��ʽ���������ʹ���ʽ��ͣ���˼���������Ϊ������BiCl3ˮ�⣬������Ԫ�ص���ġ����������ͬʱ�����ܽ�Bi2O3�ȡ�
BiOCl+2H+��2Cl����ӦҺ���뱣��ǿ���ԣ�������Ԫ�ػ���BiOCl����ʽ�Ȼ��飩��ʽ���������ʹ���ʽ��ͣ���˼���������Ϊ������BiCl3ˮ�⣬������Ԫ�ص���ġ����������ͬʱ�����ܽ�Bi2O3�ȡ�
��2��Bi����FeCl3��Һ���ֳ���ԭ�ԣ�Bi+3FeCl3��BiCl3+3FeCl2��
��3����ϣ�1���ķ�������֪�����еĵ�����S��
��4����BiCl3��Һ�м������ۣ������û���Ӧ������Bi3+��ԭΪBi�����������������ӣ�2Bi3++3Fe=3Fe2++2Bi����Һ����Ҫ�������Ȼ��������Ȼ��������ڹ�����ת��Ϊѭ�����õ�ԭ�ϣ���������м�������ʿ�֪ת��Ϊ�Ȼ����������ķ�Ӧ��2FeCl2+Cl2��2FeCl3��
��5����������к���Ag2S��-2��������������S���ʣ�������������е�Cl��Ag+�������AgCl��������С�
��6�������ᴿ���ƴ�ͭ�ľ���������Ӧ����������
��7��Ag2S��KSP= ![]() ����֪��Һ�������ӵ�Ũ�ȣ��������ӵ�Ũ��Ϊ
����֪��Һ�������ӵ�Ũ�ȣ��������ӵ�Ũ��Ϊ![]() ��
��


 ������ȫ�̼����ĩ���100��ϵ�д�
������ȫ�̼����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ����2 L�����ܱ�������ʹX(g)��Y(g)������Ӧ����Z(g)����Ӧ������X��Y��Z��Ũ�ȱ仯��ͼ1��ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��Z�İٷֺ�����ʱ��Ĺ�ϵ��ͼ2��ʾ�������н�����ȷ����
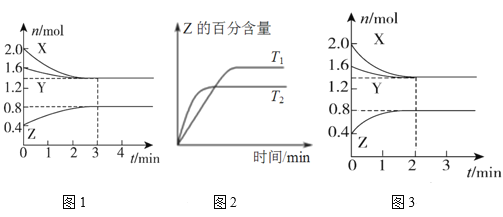
A. �����з����ķ�Ӧ�ɱ�ʾΪ3X(g)��Y(g)![]() 2Z(g)
2Z(g)
B. ��Ӧ���е�ǰ3min�ڣ���X��ʾ�ķ�Ӧ����v(X)��0.2 mol/(L��min)
C. ���������������䣬�����¶ȣ���Ӧ�Ļ�ѧƽ�ⳣ��K��С
D. ���ı䷴Ӧ������ʹ��Ӧ������ͼ3��ʾ����ı������������ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͭ��Ӧ�����ձ�Ľ�����
��1��ͭ��ӡˢ��·��ҵ����Ҫ���ϡ���H2O2��H2SO4�Ļ����Һ���ܳ�ӡˢ��·�������ĩ�е�ͭ���ǹ�ҵ�ϲ��õķ���֮һ����֪��
Cu(s) + 2H+(aq) == Cu2+(aq) + H2(g) ��H= +64.39kJ/mol
2H2O2(l) == 2H2O(l) + O2 (g) ��H= ��196.46kJ/mol
H2(g) +1/2 O2 (g)== H2O(l) ��H= ��285.84kJ/mol
��H2SO4��Һ��Cu��H2O2��Ӧ����Cu2+��H2O���Ȼ�ѧ����ʽΪ______
��2��þ���Ͻ�������Ӧ�ù㷺��ȡ��Ʒa�ˣ�����200mL5mol/L��HCl��Һ���ռ������������3.36L��a��ȡֵ��Χ_____����Ӧ����Һ�м���4mol/L NaOH��Һ____mL�����������ﵽ���ֵ��
��3����״���£���ͭ�Ͻ�ag��������ϡ�����У��ռ���һ��������NO���ڻ����67.2mLO2����ȫ��H2O���գ�������ʣ�ࡣ�����ɵ�NOΪ_________mL����Ӧ����Һ��������NaOH��Һ���õ�����������____________ g�����ú�a�Ĵ���ʽ��ʾ��
��4����ͼ��ʾ��A��FΪʯī�缫��B��EΪ��Ƭ�缫����Ҫ��ش��������⡣
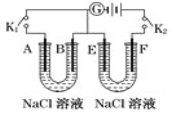
�ٴ�K2���պ�K1��BΪ____���� A�ĵ缫��ӦʽΪ��_________________________��
�ڴ�K1���պ�K2��EΪ_____����F���ĵ缫��ӦʽΪ��______________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˴Ź����������о��л���ṹ�������ֶ�֮һ��������ȩ�Ľṹ��ʽΪCH3-CHO���ں˴Ź����������������壬������֮��Ϊ3��1��
��1���ṹʽΪ![]() ���л���ں˴Ź������������շ�����֮��Ϊ __________��
���л���ں˴Ź������������շ�����֮��Ϊ __________��
��2��ij�����л��������ͼ������ʺɱ�Ϊ46.0��̼����������Ϊ52.2%�������������Ϊ13.0%���˴Ź���������ֻ��һ�����շ壬����л������Է�������Ϊ___________����ṹ��ʽ�� _________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��CPAE�Ƿ佺����Ҫ���Գɷ֣�Ҳ���ɿ�����ϳ�.����˵������ȷ����

A�����������������̼ԭ�ӿ��ܴ���ͬһ��ƽ����
B��1molCPAE����������ˮ��Ӧ���������3molBr2
C��1mol���Ҵ���O2����ȫȼ�գ�������10molO2
D��1molCPAE��������NaOH��Һ��Ӧ���������3molNaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���� ( )
����������ͬ������һ������ͬ��Ԫ�� ��ͬλ�ص����������нϴ������ѧ���ʼ�����ȫ��ͬ ��Ԫ��������������������ԭ������������������������ͬ������Ԫ����Ҫ��ѧ�������������������� �ܵ�������ͬ�����Ӳ�һ����ͬһ��Ԫ�� ��ÿ��Ԫ�ض������ֻ������Եĺ���
A.�٢ڢܢ�B.�ۢܢ�C.�ڢۢ�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3����ԭNO����Ҫ�����������������䷴Ӧ������������ϵ����ͼ���о���������Fe2O3Ϊ���Ĵ����Ͽ��ܷ����ķ�Ӧ��������ͼ![]() ����˵����ȷ����
����˵����ȷ����
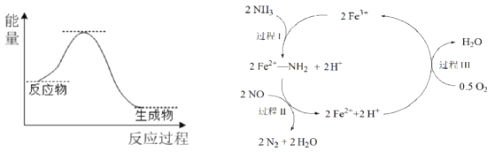
A.NH3����ԭNOΪ���ȷ�Ӧ
B.��������NH3�������Ӽ�
C.��������NOΪ��������Fe2+Ϊ��ԭ��
D.�������ܷ�ӦΪ��4NH3(g)��4NO(g)��O2(g) ![]() 4N2(g)��6H2O(g)
4N2(g)��6H2O(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽���ܴﵽʵ��Ŀ�ĵ��ǣ����ּг�װ������ȥ��
|
|
|
|
A֤���������Ա� ����ǿ | Bʵ������ ���������� | Cʵ�����ư��� | D֤��̼���������ȶ� �Ա�̼������ |
A.AB.B��C.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ�������������1mol CH4��Cl2��Ӧ���õ������ʵ�����4���л�ȡ������������Cl2���ʵ���Ϊ
A.2.5molB.2molC.1molD.10mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com