
【题目】某小组设计实验对硫燃烧的产物及其性质进行验证,实验装置如下图所示。
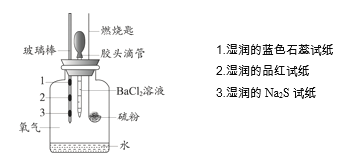
下列实验事实与所得结论相符的是
实验事实 | 所得结论 | |
A | 湿润的品红试纸褪色 | 证明硫燃烧的产物中有SO2 |
B | 湿润的Na2S试纸上出现淡黄色固体 | 证明硫的燃烧产物能被还原成硫 |
C | 湿润的蓝色石蕊试纸变红 | 证明硫的燃烧产物中有酸类物质 |
D | 加入BaCl2溶液产生白色沉淀 | 证明硫燃烧的产物中有SO3 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知:
Cu(s) + 2H+(aq) == Cu2+(aq) + H2(g) △H= +64.39kJ/mol
2H2O2(l) == 2H2O(l) + O2 (g) △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)== H2O(l) △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为______
(2)镁铝合金生活中应用广泛。取样品a克,溶于200mL5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围_____,向反应后溶液中加入4mol/L NaOH溶液____mL,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mLO2后,可完全被H2O吸收,无气体剩余。则生成的NO为_________mL;向反应后溶液加足量的NaOH溶液,得到沉淀的质量____________ g。(用含a的代数式表示)
(4)如图所示,A,F为石墨电极,B,E为铁片电极。按要求回答下列问题。
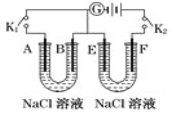
①打开K2,闭合K1,B为____极, A的电极反应式为:_________________________。
②打开K1,闭合K2,E为_____极,F极的电极反应式为:______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如左图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如右图![]() 下列说法正确的是
下列说法正确的是
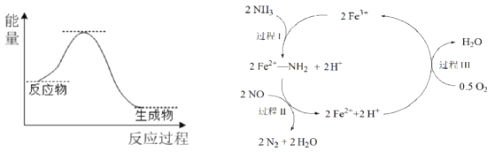
A.NH3催化还原NO为吸热反应
B.过程Ⅰ中NH3断裂离子键
C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂
D.脱硝的总反应为:4NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到实验目的的是(部分夹持装置已略去)
|
|
|
|
A证明醋酸酸性比 硼酸强 | B实验室制 氢氧化亚铁 | C实验室制氨气 | D证明碳酸氢钠热稳定 性比碳酸钠弱 |
A.AB.B…C.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的化学式为C8H10,能使酸性KMnO4溶液褪色。
(1)若分子中含有一个苯环,则该烃属于_____,是_____的同系物。该烃具有_____种同分异构体。
(2)若为链烃且有两个甲基取代基,写出一种分子中只含叁键的同分异构体的结构简式:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】优化反应条件是研究化学反应的重要方向。
(1)以硫代硫酸钠与硫酸的反应Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
实验序 号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
Ⅰ | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
Ⅱ | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
Ⅲ | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
①表中,a为______,b为______。
②实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象为_______。
③硫代硫酸钠可用于从含氧化银的矿渣中浸出银,反应如下:Ag2O+4S2O32-+H2O2[Ag(S2O3)2]3-+2OH-。在实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因:_________。
(2)工业上常用空气催化氧化法除去电石渣浆(含 CaO)上清液中的S2-,并制取石膏(CaSO42H2O),其中的物质转化过程如图所示。

①过程Ⅰ、Ⅱ中,起催化剂作用的物质是_________。
②过程Ⅱ中,反应的离子方程式为________。
③根据物质转化过程,若将10L上清液中的S2-转化为SO42-(S2-浓度为320mg/L),理论上共需要标准状况下的O2的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在光照条件下,将1mol CH4与Cl2反应,得到等物质的量的4种有机取代物,则消耗Cl2物质的量为
A.2.5molB.2molC.1molD.10mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积固定的密闭容器中加入反应物A、B,发生反应:A(g)+2B(g)=3C(g)。反应2 min后,A的浓度从开始时的1.0 mol·L-1降到0.8 mol·L-1。已知反应开始时B的浓度是1.2 mol·L-1。求:(1)2 min末B、C的浓度____。(2)以单位时间内A的浓度的减小来表示2 min内该反应的平均速率_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com