
| A、0.8 mol |
| B、1.1 mol |
| C、1.2 mol |
| D、2.0 mol |
| 11.2L |
| 22.4L/mol |
| 19.2g |
| 64g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、被氧化的元素和被还原的元素的质量之比5:1 |
| B、Cl2既是氧化产物,又是还原产物 |
| C、盐酸既体现酸性,又体现还原性 |
| D、转移5mol电子时,产生67.2L的Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4 | B、4.5 | C、5.5 | D、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
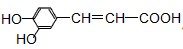
| A、咖啡酸可以发生还原、取代、加聚等反应 |
| B、咖啡酸与FeCl3溶液可以发生显色反应 |
| C、1mol咖啡酸可与4mol H2发生加成反应 |
| D、1mol咖啡酸最多能消耗3mol的NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| B | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
| C | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| D | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.500mol/L的溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | |||
| Y | Z | R | |
| W |
| A、五种元素可能都是金属元素 |
| B、X的氢化物的沸点一定比Z的氢化物的沸点高 |
| C、R的最高价氧化物对应的水化物一定是强酸 |
| D、五种元素的原子最外层电子数一定都大于2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com