
【题目】在某有机物A的分子中,具有酚羟基、醇羟基、羟基等官能团,其结构简式如图。

①A跟NaOH溶液反应的化学方程式是__________________;
②A跟NaHCO3溶液反应的化学方程式是_____________________;
③A在一定条件下跟Na反应的化学方程式是:____________________________。
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】已知Be在周期表中位于Al的左上方,则下列有关Be的说法中错误的是
A.单质Be与酸或碱反应都能放出氢气B.Be(OH)2为两性氢氧化物
C.Be的氧化物的化学式为Be2O3D.BeCl2晶体属于分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式为  ,取Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、NaHCO3三种物质的物质的量为
,取Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、NaHCO3三种物质的物质的量为
A. 2:2 :1 B. 1:1:1 C. 3:2:1 D. 3:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知葡萄糖在乳酸菌作用下可转化为乳酸(C3H6O3)。
(1)取9 g乳酸与足量的金属Na反应,可生成2.24 L H2(标准状况),另取等量乳酸与等物质的量的乙醇反应,生成0.1 mol乳酸乙酯和1.8 g水,由此可推断乳酸分子中含有的官能团名称为____________。
(2)乳酸在Cu作催化剂时可被氧化成丙酮酸(![]() ),由以上事实推知乳酸的结构简式为________________。
),由以上事实推知乳酸的结构简式为________________。
(3)两个乳酸分子在一定条件下脱水生成环脂(C6H8O4),则此环酯的结构简式是____。
(4)乳酸在浓H2SO4作用下,三分子相互反应,生成链状结构的物质,写出其生成物的结构简式:___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据我国目前汽车业发展速度,预计![]() 年汽车保有量超过
年汽车保有量超过![]() 亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。
亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。
(1)目前,汽车厂商常利用催化技术将尾气中的![]() 和
和![]() 转化成
转化成![]() 和
和![]() ,化学方程式为:_______________;
,化学方程式为:_______________;
为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究:
(资料查阅)①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
(实验设计)课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(2)完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | T / ℃ |
|
| 同种催化剂的比表面积
|
| 为以下实验作参照 |
|
|
|
|
| ①___________ | 280 |
|
|
|
| 探究温度对尾气转化速率的影响 |
| ②_________ |
|
|
(图象分析与结论)利用气体传感器测定了三组实验中![]() 浓度随时间变化的曲线图,如图:
浓度随时间变化的曲线图,如图:
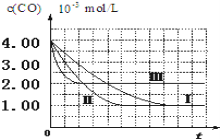
(3)计算第![]() 组实验中,达平衡时
组实验中,达平衡时![]() 的浓度为________;
的浓度为________;
(4)由曲线![]() 、
、![]() 可知,增大催化剂比表面积,汽车尾气转化速率____________________(填“增大”、“减小”、“无影响”)。
可知,增大催化剂比表面积,汽车尾气转化速率____________________(填“增大”、“减小”、“无影响”)。
(5)下列措施中,能减少或控制汽车尾气污染有效且可行的是________.
A.制定严格的汽车尾气排放标准,并严格执行
B.开发清洁能源汽车,如氢能汽车、太阳能汽车等
C.将污染源移到人口密集度低的郊区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月4日《光明日报》报道称,中科院大连化学物理研究所的研究团队利用多功能催化剂首次实现了CO2直接加氢制汽油的过程。其转化过程如图所示。
![]()
下列说法正确的是( )
A. 反应①的产物中含有水
B. 反应②为化合反应
C. 所制得汽油的主要成分是烃和烃的含氧衍生物
D. 这种人造汽油用作汽车的燃料时,汽车尾气不含氮氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,气体A为无色有毒气体,气体B为黄绿色气体,请根据下图完成填空。

(1)A是________,E是________;
(2)A与B在水溶液中反应的离子方程式是:______;
(3)分别将气体A与B通入如下装置,待一段时间后,分别加热甲、乙两支试管。
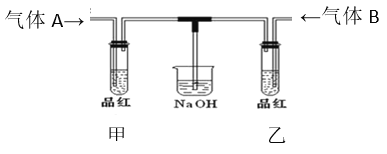
①试管甲中的实验现象为_______________,原因是_________________________;
②试管乙中的实验现象为_________________________,原因是___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 化石燃料不一定在任何条件下都能充分燃烧
B. 化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C. 直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D. 固体煤变为气体燃料后,燃烧效率将更低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com