
【题目】根据我国目前汽车业发展速度,预计![]() 年汽车保有量超过
年汽车保有量超过![]() 亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。
亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。
(1)目前,汽车厂商常利用催化技术将尾气中的![]() 和
和![]() 转化成
转化成![]() 和
和![]() ,化学方程式为:_______________;
,化学方程式为:_______________;
为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究:
(资料查阅)①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
(实验设计)课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(2)完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | T / ℃ |
|
| 同种催化剂的比表面积
|
| 为以下实验作参照 |
|
|
|
|
| ①___________ | 280 |
|
|
|
| 探究温度对尾气转化速率的影响 |
| ②_________ |
|
|
(图象分析与结论)利用气体传感器测定了三组实验中![]() 浓度随时间变化的曲线图,如图:
浓度随时间变化的曲线图,如图:
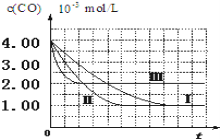
(3)计算第![]() 组实验中,达平衡时
组实验中,达平衡时![]() 的浓度为________;
的浓度为________;
(4)由曲线![]() 、
、![]() 可知,增大催化剂比表面积,汽车尾气转化速率____________________(填“增大”、“减小”、“无影响”)。
可知,增大催化剂比表面积,汽车尾气转化速率____________________(填“增大”、“减小”、“无影响”)。
(5)下列措施中,能减少或控制汽车尾气污染有效且可行的是________.
A.制定严格的汽车尾气排放标准,并严格执行
B.开发清洁能源汽车,如氢能汽车、太阳能汽车等
C.将污染源移到人口密集度低的郊区
【答案】2NO + 2CO![]() 2CO2 + N2 探究催化剂比表面积对尾气转化速率的影响 6.50×10—3 3.50×10—3 mol/L 增大 AB
2CO2 + N2 探究催化剂比表面积对尾气转化速率的影响 6.50×10—3 3.50×10—3 mol/L 增大 AB
【解析】
(1)利用催化技术将尾气中的NO和CO转化成氮气和二氧化碳,反应的化学方程式为2NO+2CO![]() 2CO2+N2;
2CO2+N2;
(2)影响反应速率的因素有浓度、压强、温度和催化剂的比表面积,而要想探究一种影响因素,必须保持其他影响因素是一致;Ⅰ、Ⅱ比较不同的是催化剂的比表面积,则实验目的是探究催化剂比表面积对尾气转化速率的影响;Ⅲ是探究温度对尾气转化速率的影响,温度是变量,其余保持不变,则NO的初始浓度为6.50×10—3mol/L;
(3)通过图象可知,第Ⅰ组实验中达到平衡时CO的平衡浓度为1.00×10—3mol/L,可得出CO的浓度该变量△C(CO)=4.00×10—3mol/L-1.00×10—3 mol/L=3.00×10—3 mol/L,在一个反应中,各物质的浓度的该变量之比等于计量数之比,故NO的浓度的该变量△c(NO)=3.00×10—3mol/L,故NO的平衡浓度c(NO)=6.50×10—3 mol/L-3.00×10—3mol/L=3.50×10—3mol/L;
(4)由图象可知,增大催化剂比表面积后,缩短了到达平衡的时间,故增大了反应速率。
(5)A.制定严格的汽车尾气排放标准,并严格执行,能减少或控制汽车尾气污染,A正确;
B.开发清洁能源汽车,如氢能汽车、太阳能汽车等,能减少或控制汽车尾气污染,B正确;
C.将污染源移到人口密集度低的郊区,不能减少或控制汽车尾气污染,C错误;
答案选AB。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】已知甲烷的燃烧热为890.3 kJmol-1。氢气的燃烧热为285.8 kJmol-1。现有9 mol的甲烷和氢气的混合气体,完全燃烧后放出热量7408.2 kJ,则该混合气体中甲烷和氢气的物质的量比为( )
A. 1∶8 B. 8∶1 C. 4∶17 D. 17∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合成氨的热化学方程式为:N2(g)+ 3H2(g)![]() 2NH3(g)△H=-92kJ/mol,下列说法中正确的是
2NH3(g)△H=-92kJ/mol,下列说法中正确的是
A. 当1molN2与3molH2充分反应,可放出92kJ热量
B. 恒容恒温发生该反应时,向容器中充入少量He,反应速率加快且平衡正向移动
C. 恒压恒温发生该反应时,向容器中充入少量He,反应速率不变且平衡不移动
D. 升高温度时,正、逆反应速率都加快,而逆反应速率增加更多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵是一种重要的化工原料,通常用合成氨及合成硝酸的产物进行生产
(1)硝酸铵水溶液pH__________7(填“>”、“=”或“<”),其水溶液中各种离子浓度大小关系为___________
(2)已知合成氨的热化学方程式为:N2(g)+ 3H2(g)![]() 2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
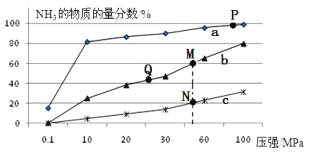
①曲线c对应的温度为___________ ℃
②下列说法中正确的是___________
A.增大氢气浓度,可促进平衡正向移动并能提高氮气的转化率
B.Q点对应的反应条件下,若加入适当的催化剂,可提高NH3在混合物中的物质的量分数
C.M、N两点的平衡常数大小关系为:M>N
D.M、N、Q三点反应速率的大小关系为:N>M>Q
E.为了尽可能多的得到NH3,应当选择P点对应的温度和压强作为生产条件
(3)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(4)柴油汽车尾气净化器通常用尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,请写出尿素与NO反应的化学方程式__________,当有1mol尿素完全反应时,转移电子的数目为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.金属氧化物都能与水反应生成碱
B.非金属氧化物都能与水反应生成酸
C.氧化铝既能与盐酸反应又能与氨水反应
D.氧化铝是冶炼金属铝的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某有机物A的分子中,具有酚羟基、醇羟基、羟基等官能团,其结构简式如图。

①A跟NaOH溶液反应的化学方程式是__________________;
②A跟NaHCO3溶液反应的化学方程式是_____________________;
③A在一定条件下跟Na反应的化学方程式是:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,下图所示是有关合成路线图。
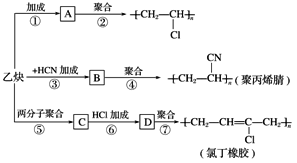
已知反应:
nCH2===CH—CH===CH2![]()
![]()
请完成下列各题:
(1)写出下列物质的结构简式:
A________________,C________________。
(2)写出下列反应的化学方程式:
反应②________________________________________________________________________;
反应③________________________________________________________________________;
反应⑥________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com