
【题目】化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A. 定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B. 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C. 检验溶液中是否含有Fe2+时,用硝酸酸化
D. 检验溶液中是否含有SO![]() 时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知2H2O2(1)=2H2O(1)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是

A. 该反应的△H<0,△S>0
B. 途径Ⅱ与途径I相比,可能是加了催化剂
C. 其他条件相同时,产生相同体积的氧气时放出的热量:途径I >途径Ⅱ
D. 其他条件相同时,产生相同体积的氧气所需的时间:途径I>途径Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:

锌为__极,该电极上发生__反应(“氧化”或“还原”),电极反应式为__,该原电池的总反应离子方程式为__.
II.(1)氮化钠的电子式是_____________。
(2)氮化钠与水反应的化学方程式是__________________。
(3)氮化钠与盐酸反应生成_______种盐。
(4)氮化钠中两种微粒的半径大小比较: r(Na+)___r(N3-)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子(不考虑水电离出的H+和OH-),其物质的量之比为n(Na+): n(Mg2+): n(Cl-)=3:5:5。若Na+的物质的量为3mol,则SO42-的物质的量为
A. 2mol B. 3mol C. 4mol D. 8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元
素的含量。实验步骤如下:
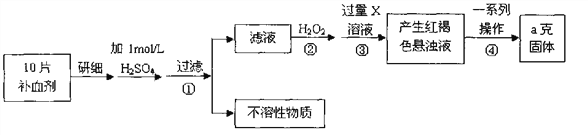
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法________________________________,该
过程的现象为:______________________________
(2)步骤②加入过量H2O2的目的(用离子方程式表示):_______________。
(3)步骤③中反应的离子方程式:_______________________________________。
(4)实际上向滤液中直接滴加X溶液最终也会生成红褐色浊液,此过程中发生的
氧化还原反应为(用化学方程式表达)_________________________。
(5)步骤④中最终得到a克红棕色粉末,则一系列处理的操作步骤:_________、
洗涤、_________、冷却、称量。
(6)若实验无损耗,则每片补血剂含铁元素的质量__________g。
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4·7H2O的片剂
来补充铁,则正常人每天服需用含______________mgFeSO4·7H2O的片剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法一定正确的是( )
A. 用湿润的pH试纸测溶液的pH
B. 实验室制备干燥纯净的氯气时,气体先通过饱和食盐水再通过浓硫酸
C. 用玻璃棒在过滤器上搅拌以加速AgCl沉淀的洗涤
D. 中和滴定实验中,锥形瓶用蒸馏水洗净后未干燥,测定结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在一定条件下反应,可以制得较纯净一氯乙烷的是
A. 乙烷与氯气取代B. 乙烯与氯化氢加成
C. 乙烯与氯气加成D. 乙烯与氢气加成,再用氯气取代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镁晶体是一种新型吸波隐形材料中的增强剂。
I.合成该物质的步骤如下:
步骤 1:配制一定浓度的![]() 溶液和
溶液和![]() 溶液。
溶液。
步骤 2:量取一定量的![]() 溶液于容器中,搅拌并逐滴加入
溶液于容器中,搅拌并逐滴加入![]() 溶液,温度控制在 50℃, 用氨水调节溶液 pH 到 9.5。
溶液,温度控制在 50℃, 用氨水调节溶液 pH 到 9.5。
步骤 3:放置1 h后,过滤、洗涤、干燥,得碳酸镁晶体产品[![]() (n=1~5)]。
(n=1~5)]。
回答下列问题:
(1)配制 250 mL 0.5mol/LMgSO4溶液,所需的玻璃仪器除烧杯、玻璃棒和量筒外还有_________。
(2)步骤 2 中反应的离子方程式为_____________________。
(3)检验碳酸镁晶体是否洗干净的方法是_______________________。
Ⅱ.测定产品![]() 中的 n 值(仪器和药品如图所示):
中的 n 值(仪器和药品如图所示):

(4)上述装置的连接顺序为______(按气流方向,用接口字母表示),其中 C 的作用是_________。
(5)加热前先通入![]() 排尽装置中的空气,称取装置 C、D 的初始质量后,边加热边通入
排尽装置中的空气,称取装置 C、D 的初始质量后,边加热边通入![]() 的作用是________。
的作用是________。
(6)若装置 B 中无残留物,要准确测定 n 值,至少需要下列所给数据中的____(填选项字母),写出相应的数学表达式:n=______。
①装置 A 反应前后质量差![]() ②装置 C 反应前后质量差
②装置 C 反应前后质量差![]() ③装置 D 反应前后质量差
③装置 D 反应前后质量差![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com