
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元
素的含量。实验步骤如下:
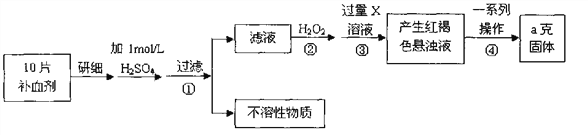
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法________________________________,该
过程的现象为:______________________________
(2)步骤②加入过量H2O2的目的(用离子方程式表示):_______________。
(3)步骤③中反应的离子方程式:_______________________________________。
(4)实际上向滤液中直接滴加X溶液最终也会生成红褐色浊液,此过程中发生的
氧化还原反应为(用化学方程式表达)_________________________。
(5)步骤④中最终得到a克红棕色粉末,则一系列处理的操作步骤:_________、
洗涤、_________、冷却、称量。
(6)若实验无损耗,则每片补血剂含铁元素的质量__________g。
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4·7H2O的片剂
来补充铁,则正常人每天服需用含______________mgFeSO4·7H2O的片剂。
【答案】 先滴加KSCN溶液,再滴加新制氯水(或双氧水、稀硝酸等合理氧化剂) 现象:先无明显变化,滴加新制氯水后溶液变为血红色 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3OH—==Fe(OH)3↓(或Fe3++3NH3·H2O==Fe(OH)3↓+3NH4+) 4Fe(OH)2+O2+2H2O===4Fe(OH)3 过滤 灼烧 0.07a 69.5mg
【解析】(1)检验Fe2+,先加KSCN溶液,溶液不变红,再加新制氯水或H2O2,溶液变红,说明含有溶液中含有Fe2+;现象是开始不变红,滴加氧化剂溶液后,溶液变为血红色;(2)加入H2O2的目的是把Fe2+氧化成Fe3+,即2Fe2++H2O2+2H+=2Fe3++2H2O;(3)③中加入X后出现红褐色沉淀,此沉淀是Fe(OH)3,X为碱,因此反应式为:Fe3++3OH-==Fe(OH)3↓(或Fe3++3NH3·H2O==Fe(OH)3↓+3NH4+);(4)Fe2+和碱中OH-反应生成Fe(OH)2,Fe(OH)2容易被氧气氧化成Fe(OH)3,发生4Fe(OH)2+O2+2H2O===4Fe(OH)3;(5)2Fe(OH)3![]() Fe2O3+3H2O,因此步骤为过滤、洗涤、灼烧、冷却、称量;(6)根据铁元素守恒,铁元素的质量为2a×56/(160×10)g=0.07ag;(7)根据铁元素守恒,14×278/56mg=69.5mg。
Fe2O3+3H2O,因此步骤为过滤、洗涤、灼烧、冷却、称量;(6)根据铁元素守恒,铁元素的质量为2a×56/(160×10)g=0.07ag;(7)根据铁元素守恒,14×278/56mg=69.5mg。


科目:高中化学 来源: 题型:
【题目】在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中加入足量的Na2O2固体,充分作用后,再加入过量的稀盐酸,完全反应,则离子数目没有变化的是( )
A.Fe3+、Al3+ B.Al3+
C.Fe2+、NH4+ D.Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的铝分别与等物质的量浓度的稀硫酸和氢氧化钠溶液反应,放出的气体体积在标准状况下相等,则所取稀硫酸和氢氧化钠溶液的体积比为 ( )
A. 1︰2 B. 3︰2 C. 3︰1 D. 6︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两份质量相同的碳酸氢钠固体,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸,充分反应,则它们所耗用的盐酸的体积比为( )
A. 2∶1 B. 1∶1 C. 1∶2 D. 4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A. 定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B. 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C. 检验溶液中是否含有Fe2+时,用硝酸酸化
D. 检验溶液中是否含有SO![]() 时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关。下列说法正确的是( )
A. 明矾、漂白粉、臭氧的净水原理相同
B. 硅胶可用作干燥剂
C. 煤的干馏和石油的分馏都属于物理变化
D. 亚硝酸钠是一种食品防腐剂,使用时其用量可以不加限制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。
(1)写出实验室制取氯气反应的化学方程式________________________。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
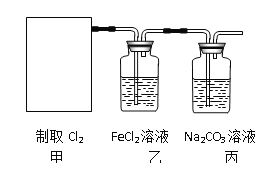
①在该实验中,甲部分的装置是_______(填字母)。

②乙装置中FeCl2溶液与Cl2反应的离子方程式是________________。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质,这种物质是_______(化学式)。
④有人认为该实验存在明显的缺陷,请你将认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂。______________
请你写出Cl2和“④”中“最合适的化学试剂”反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐水过滤后仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤可以除去这些杂质。
①加入稍过量的Na2CO3溶液; ②加入稍过量的NaOH溶液:
③加入稍过量的BaCl2溶液: ④过滤; ⑤滴入稀盐酸至无气泡产生。
正确的操作顺序是
A. ①③②④⑤ B. ③②①④⑤ C. ②③①⑤④ D. ③④②①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com