
| 1 |
| 2 |
| 4.48L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
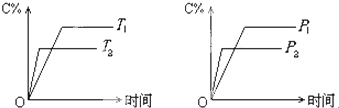
| A、达到平衡后,若使用催化剂,C的体积分数增大 |
| B、达到平衡后,若使温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中n>c+f |
| D、达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
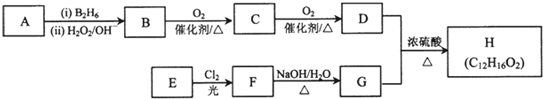
| (i)B2H6 |
| (ii)H2O2/OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入烧碱溶液,微热时有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则原溶液中有NH4+ |
| B、加入盐酸无现象,再加BaCl2溶液,有白色沉淀生成,则原溶液中有SO42- |
| C、加入盐酸有无色气体逸出,该气体能使澄清石灰水变浑浊,则原溶液有CO32- |
| D、加入Ba(OH)2溶液,有白色沉淀生成,则原溶液中有 SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
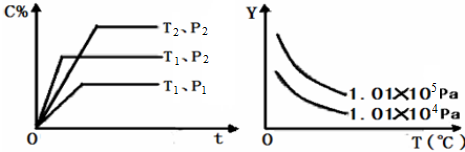
| A、平衡混合气中物质A的百分含量 |
| B、平衡混合气中物质B的百分含量 |
| C、平衡混合气的平均摩尔质量 |
| D、平衡混合气的密度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com