
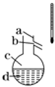
 现有乙酸乙酯、乙醇和乙酸的混合溶液,某课外活动小组的同学欲从乙酸乙酯中回收乙醇和乙酸,重新加以利用.请根据给出实验数据和用品,回答下列问题:参考数据:
现有乙酸乙酯、乙醇和乙酸的混合溶液,某课外活动小组的同学欲从乙酸乙酯中回收乙醇和乙酸,重新加以利用.请根据给出实验数据和用品,回答下列问题:参考数据:| 乙醇 | 乙酸 | 乙酸乙酯 | 乙酸钠 | |
| 熔点(℃) | -117.3 | 16.7 | -83.6 | 324 |
| 沸点(℃) | 78.4 | 118 | 77.1 |
| △ |
| △ |


科目:高中化学 来源: 题型:
13 6 |
14 7 |
13 6 |
12 6 |
14 6 |
14 7 |
15 7 |
14 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7种 | B、8 种 |
| C、9种 | D、10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
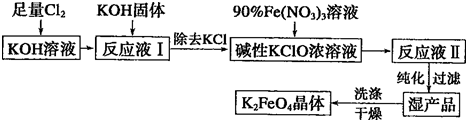

查看答案和解析>>
科目:高中化学 来源: 题型:
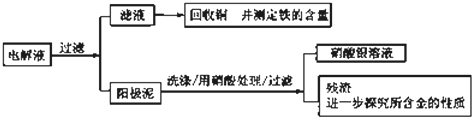
| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3?Au(NO3)3+3NO2↑+3H20 | <<1 |
| 2 | Au3++4Cl-?AuCl4 _ | >>1 |
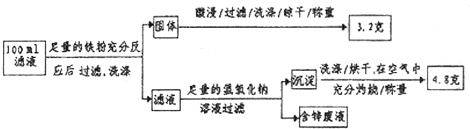
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[Cr(H2O)6]Cl3 |
| B、[Cr(H2O)5Cl]Cl2 |
| C、[Cr(H2O)4Cl2]Cl |
| D、[Cr(H2O)3Cl3] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制溶液时容量瓶中原来有少量蒸馏水不会影响实验结果 |
| B、称量时,将固体NaOH放在托盘天平左盘纸片上 |
| C、固体溶解后冷却到室温,然后将溶解后溶液转移到容量瓶中,立即向容量瓶中直接加水稀释到刻度线 |
| D、将40gNaOH固体溶于1 L水中可配成1mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水中只含Cl2和H2O分子 |
| B、新制氯水可使蓝色石蕊试纸先变红后褪色 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后漂白能力会增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com