
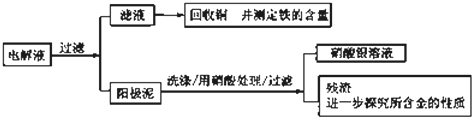
| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3?Au(NO3)3+3NO2↑+3H20 | <<1 |
| 2 | Au3++4Cl-?AuCl4 _ | >>1 |
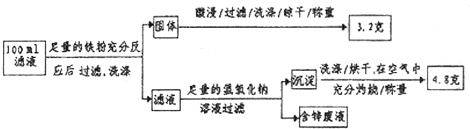
| n |
| V |
| 0.05mol |
| 0.1L |
| 4.8g |
| 160g/mol |
| n |
| V |
| 0.06mol |
| 0.1L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.36L |
| B、6.72L |
| C、5.60L |
| D、2.80L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
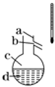 现有乙酸乙酯、乙醇和乙酸的混合溶液,某课外活动小组的同学欲从乙酸乙酯中回收乙醇和乙酸,重新加以利用.请根据给出实验数据和用品,回答下列问题:参考数据:
现有乙酸乙酯、乙醇和乙酸的混合溶液,某课外活动小组的同学欲从乙酸乙酯中回收乙醇和乙酸,重新加以利用.请根据给出实验数据和用品,回答下列问题:参考数据:| 乙醇 | 乙酸 | 乙酸乙酯 | 乙酸钠 | |
| 熔点(℃) | -117.3 | 16.7 | -83.6 | 324 |
| 沸点(℃) | 78.4 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
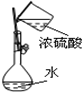 |  |  | 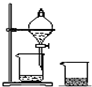 |
| A.配制硫酸溶液时,将浓硫酸慢慢注入盛有水的容量瓶中进行配制 | B.用托盘天平称量药品时,将药品置于天平左盘 | C.将混合液蒸馏分离时,应使温度计水银球浸没在混合液中 | D.分液时,将上下层液体依次从分液漏斗下口分别流入两个烧杯中 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、①和④ |
| C、③和⑤ | D、②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使水的温度升高 |
| B、增加水中O2的含量 |
| C、起到杀菌作用 |
| D、使水中HClO分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com