
| A、3.36L |
| B、6.72L |
| C、5.60L |
| D、2.80L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、 |
B、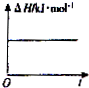 |
C、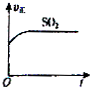 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7种 | B、8 种 |
| C、9种 | D、10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
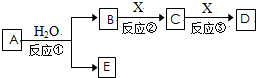
查看答案和解析>>
科目:高中化学 来源: 题型:
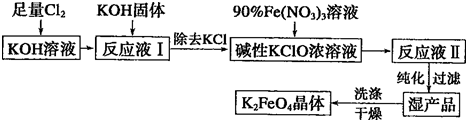

查看答案和解析>>
科目:高中化学 来源: 题型:
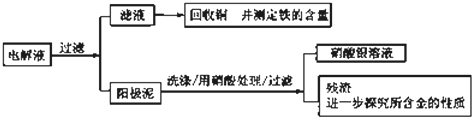
| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3?Au(NO3)3+3NO2↑+3H20 | <<1 |
| 2 | Au3++4Cl-?AuCl4 _ | >>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制溶液时容量瓶中原来有少量蒸馏水不会影响实验结果 |
| B、称量时,将固体NaOH放在托盘天平左盘纸片上 |
| C、固体溶解后冷却到室温,然后将溶解后溶液转移到容量瓶中,立即向容量瓶中直接加水稀释到刻度线 |
| D、将40gNaOH固体溶于1 L水中可配成1mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达平衡时HBr物质的量一定仍为a mol | ||
| B、两平衡压强比为3:(x+y+z) | ||
C、达平衡时HBr的物质的量为
| ||
| D、x、y、z应满足的关系是 4x+z=2y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com