
【题目】甲、乙、丙、丁是原子序数依次增大的四种短周期元素,A,B,C,D,E是由其中的两种或三种元素组成的化合物,F是由丙元素形成的单质.已知:A+B=D+F,A+C=E+F; 0.1 molL﹣1D溶液的pH为13(25℃).下列说法正确的是( )
A.原子半径:丁>丙>乙>甲
B.乙元素在周期表中的位置为第三周期第ⅣA族
C.1 molA与足量B完全反应共转移了1 mol电子
D.1.0 L 0.1 molL﹣1E溶液中阴离子总的物质的量小于0.1 mol
【答案】C
【解析】解:0.1 molL﹣1D溶液的pH为13(25℃),D是一元强碱,其含有的金属元素在短周期,则D应为NaOH,由反应:A+B=D+F,根据元素守恒可知,A、B两种物质至少共含有H、O、Na元素,F是由丙组成的单质,由发生反应可知,丙不能是Na,结合原子数可知,甲为H、丙为O、丁为Na元素,故F为氧气,可知A是Na2O2、B是水,再根据反应:A+C=E+F,可知C是二氧化碳,E是碳酸钠,则乙为C元素.
A.所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大,则原子半径大小顺序为:Na>C>O>H,即:丁>乙>丙>甲,故A错误;
B.乙为碳元素,处于周期表中第二周期ⅣA族,故B错误;
C.A与足量的B完全反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,反应中过氧化钠起氧化剂、还原剂作用,各占一半,故1molNa2O2反应转移的电子为1mol× ![]() ×2×[0﹣(﹣1)]=1mol,故C正确;
×2×[0﹣(﹣1)]=1mol,故C正确;
D.E是碳酸钠,溶液中CO32﹣离子水解生成HCO3﹣离子和OH﹣离子,溶液中阴离子总的物质的量大于0.1mol,故D错误;
故选C.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】已知一定条件下合成氨反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
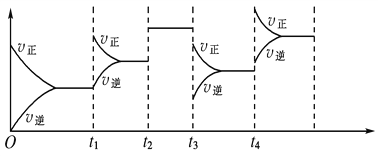
t1________________; t2______________; t3________________; t4______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)25℃、101kPa时,使1.0 g乙烯与足量的氧气反应,生成CO2和液态H2O并放出50 KJ的热量,表示乙烯燃烧热的热化学方程式为_________________________。
(2)比较下列热化学方程式中ΔH的大小关系。
CH4 (g)+2O2 (g)===CO2 (g)+2H2O (l) ΔH1
CH4 (g)+2O2 (g)===CO2 (g)+2H2O (g) ΔH2
则ΔH1________ΔH2
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C (s,石墨) + O2 (g) = CO2 (g) ΔH1
2H2 (g) + O2 (g ) =2H2O (l) ΔH2
2C2H2 (g) + 5 O2 (g ) =4 CO2 (g)+2 H2O (1) ΔH3
则2C (s,石墨)+ H2 (g)= C2H2 (g) 反应的ΔH的表达式为:ΔH =_____。
II. 草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+ 5H2C2O4+ 6H+= 2 Mn2++ 10CO2↑ + 8H2O。现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
I | 2 mL | 20 | / |
II | 2 mL | 20 | MnSO4固体 |
III | 2 mL | 30 | / |
IV | 1 mL | 20 | 1 mL蒸馏水 |
(4)如果研究催化剂对化学反应速率的影响,使用实验_______和____ (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验_____和______。
(5)对比实验I和IV,可以研究_________________对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是 _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以2 molL-1的Na2SO4溶液为电解质溶液的钠离子电池的总反应如下:NaTi2(PO4)3+Zn+Na2SO4![]() Na3Ti2(PO4)3+ZnSO4下列有关说法正确的是
Na3Ti2(PO4)3+ZnSO4下列有关说法正确的是
A. 放电时,NaTi2(PO4)3发生氧化反应
B. 放电时,Na+向锌棒一极移动
C. 充电时,阳极反应式为[Ti2(PO4)3]--2e-=[Ti2(PO4)3]3-
D. 充电时,每转移0. 2 mol电子,阴极增重6.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X,Y,Z,M,N均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4;M原子的最外层电子数与次外电子数之比为3:4;N﹣与Ar原子电子层结构相同;X是短周期主族元素中原子半径最小的;Z是短周期主族元素中原子半径最大的;化合物XN常温下为气体.据此回答:
(1)N的最高价氧化物对应水化物的化学式是 .
(2)Z与M形成的化合物水溶液显碱性,其原因是(用离子方程式表示).
(3)X与Y,X与M均可形成18电子分子,这两种分子在水溶液中反应可观察到的现象是 , 反应的化学方程式是 .
(4)由X,Y,Z,M四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 .
(5)Y,Z,N形成的化合物的水溶液中离子浓度的大小顺序是 .
(6)如图所示: 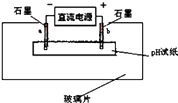
取一张用ZN溶液浸湿的pH试纸平铺在玻璃片上,取两根石墨棒做电极,接通直流电源.一段时间后,a电极处的pH试纸上可观察到的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X,Y,Z三种元素,其中Y,Z为短周期元素,;X元素在周期表的第五周期,X的负价阴离子的原子核外电子排布与氙的原子核外电子排布相同;Z和X的原子最外层电子数相等;Y有两种氧化物,其水溶液都呈碱性,其氧化物的摩尔质量分别是62g/mol和78g/mol.在X和Y化合生成物的水溶液中滴入淡黄绿色的Z单质的水溶液,溶液由无色变成深黄色.试回答:
(1)元素符号:X , Y , Z .
(2)Y的两种氧化物为和 . 写出此两种氧化物与水反应的化学方程式; .
(3)Z的单质溶于水,滴加到X和Y形成的化合物的水溶液中,可发生反应,该反应的离子方程式为 .
(4)写出Y和Z形成的化合物的电子式:;Z单质分子的电子式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用的干燥剂有:①浓硫酸(98%),②无水氯化钙,③变色硅胶[硅胶的主要成分是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂,无水氯化钴呈蓝色,吸水后变为CoCl2·6H2O呈粉红色],④五氧化二磷,⑤碱石灰(主要成分是氢氧化钠、氧化钙,制法是:把生石灰加到浓的烧碱溶液中,再加强热蒸干)。上述物质中,属于混合物的是( )
A.①②④B.②④C.①③⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物数目非常庞大,是由多种原因造成的,下列说法不确切的是( )
A.碳原子间可形成单键、双键、三键
B.碳链上碳原子可以与多种原子(或原子团)形成共价键
C.碳链化合物都非常稳定
D.碳链化合物能形成各种同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com