
����Ŀ����X��Y��Z����Ԫ�أ�����Y��ZΪ������Ԫ�أ���XԪ�������ڱ��ĵ������ڣ�X�ĸ��������ӵ�ԭ�Ӻ�������Ų���믵�ԭ�Ӻ�������Ų���ͬ��Z��X��ԭ��������������ȣ�Y�������������ˮ��Һ���ʼ��ԣ����������Ħ�������ֱ���62g/mol��78g/mol����X��Y�����������ˮ��Һ�е��뵭����ɫ��Z���ʵ�ˮ��Һ����Һ����ɫ������ɫ���Իش�
��1��Ԫ�ط��ţ�X �� Y �� Z ��
��2��Y������������Ϊ�� �� д����������������ˮ��Ӧ�Ļ�ѧ����ʽ�� ��
��3��Z�ĵ�������ˮ���μӵ�X��Y�γɵĻ������ˮ��Һ�У��ɷ�����Ӧ���÷�Ӧ�����ӷ���ʽΪ ��
��4��д��Y��Z�γɵĻ�����ĵ���ʽ����Z���ʷ��ӵĵ���ʽ�� ��
���𰸡�
��1��I��Na��Cl
��2��Na2O��Na2O2��Na2O+H2O�T2NaOH��2Na2O2+2H2O�T4NaOH+O2��
��3��Cl2+2I���T2Cl��+I2
��4��![]() ��
��![]()
���������⣺XԪ�������ڱ��ĵ������ڣ�X�ĸ��������ӵ�ԭ�Ӻ�������Ų���믵�ԭ�Ӻ�������Ų���ͬ��X��Y�����������ˮ��Һ�е��뵭����ɫ��Z���ʵ�ˮ��Һ����Һ����ɫ������ɫ����XΪI��Z��X��ԭ��������������ȣ���Ϊ����A��Ԫ�أ�ZΪ������Ԫ�أ���������ӷ���������ԭ��Ӧ����ZΪCl��Y�������������ˮ��Һ���ʼ��ԣ����������Ħ�������ֱ���62g/mol��78g/mol��������ֱ�ΪNa2O��Na2O2 �� ��YΪNa����1��XΪI��YΪNa��ZΪCl�����Դ��ǣ�I��Na��Cl����2��Na������������ֱ�ΪNa2O��Na2O2 �� �ֱ���ˮ��Ӧ�ķ���ʽΪNa2O+H2O�T2NaOH��2Na2O2+2H2O�T4NaOH+O2�������Դ��ǣ�Na2O��Na2O2��Na2O+H2O�T2NaOH��2Na2O2+2H2O�T4NaOH+O2������3��������NaI��Һ��Ӧ�û������ʵ⣬���ӷ�ӦΪCl2+2I���T2Cl��+I2 �� ���Դ��ǣ�Cl2+2I���T2Cl��+I2����4��NaClΪ���ӻ��������ʽΪ ![]() �������ĵ���ʽΪ
�������ĵ���ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
�� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ú��ʯ�͵�˵����ȷ���ǣ� ��
A.ú�ĸ����������仯
B.ʯ�͵��ѻ��������仯
C.ʯ����Ҫ����̼��������Ԫ��
D.ú�Dz���������Դ��ʯ���ǿ�������Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� �״�����Ҫ�Ļ���ԭ��,���ճ����������Ź㷺��Ӧ��.
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ����CO(g)��2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��Ӧ����CO2(g)��3H2(g)![]() CH3OH(g)+H2O(g) ��H2
CH3OH(g)+H2O(g) ��H2
�������Ʊ��״���������Ӧ��:��ӦI���ڷ�ӦII,ԭ��Ϊ_____________��
��2����֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2(g)��2CO2(g)��4H2O(l)��H1����Q1 kJ��mol
��2CO(g)+ O2(g)��2CO2(g) ��H2����Q2 kJ��mol
��H2O(g)��H2O(l) ��H3����Q3 kJ��mol
��д���״���������ȫȼ������һ����̼����̬ˮ���Ȼ�ѧ��Ӧ����ʽ��_______��
��3��ijͬѧ���ݼ״�ȼ�յķ�Ӧԭ�����������ͼ��ʾ�ĵ��װ�ã�����һ��ʱ������Һ��pH��___________������������������������������������ȼ�ϵ�ظ�����Ӧ�����ӷ���ʽΪ��________________��
�� 325K����ʼѹǿΪ100kPaʱ�������Ϊ2L���ܱ������г���4.6 g NO2 ,������Ӧ��2NO2(g)![]() N2O4(g)��
N2O4(g)��
��1��NO2��N2O4��������������Ũ�ȵĹ�ϵ��ͼ��ʾ��ͼ�н���A��ʾ�÷�Ӧ������״̬Ϊ________��

A��ƽ��״̬ B��������Ӧ�����ƶ� C�����淴Ӧ�����ƶ� D�����ж�
��2���ܹ�˵��������Ӧ�Ѿ��ﵽƽ��״̬����____________��
a��NO2��N2 O4�����ʵ������
b����ϵ��ɫ���ڱ仯
c�������ڻ��������ܶȲ��ٸı�
d������������ѹǿ�������仯
��3�����ﵽƽ��������ڻ�������ƽ����Է�������Ϊ57.5��ƽ��ʱNO2��ת����Ϊ_______���������µ�ƽ�ⳣ��K=________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ���������ԭ������������������ֶ�����Ԫ�أ�A��B��C��D��E�������е����ֻ�����Ԫ����ɵĻ����F���ɱ�Ԫ���γɵĵ��ʣ���֪��A+B=D+F��A+C=E+F�� 0.1 molL��1D��Һ��pHΪ13��25�棩������˵����ȷ���ǣ� ��
A.ԭ�Ӱ뾶�����������ң���
B.��Ԫ�������ڱ��е�λ��Ϊ�������ڵڢ�A��
C.1 molA������B��ȫ��Ӧ��ת����1 mol����
D.1.0 L 0.1 molL��1E��Һ���������ܵ����ʵ���С��0.1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и߷��Ӳ��ϲ���ֱ�ӽӴ�ʳƷ���ǣ� ��
A.�۱�ϩB.����ϩC.������ϩD.�۶Ա��������Ҷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�ص�����������Ӧ��ˮ����������ǿ����
A.ԭ�ӵ�L���Ӳ�p���ֻ�����������ӵ�Ԫ��
B.��Χ�����Ų�ʽΪ3s23p2��Ԫ��
C.����������7���۵��ӵ�Ԫ��
D.3p������Ӱ������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
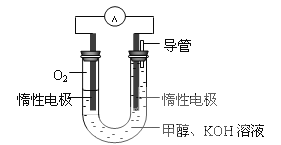
����Ŀ����SO![]() ��Fe2����Br����I����0.1 mol����Һ��ͨ���״���µ�Cl2��ͨ��Cl2���������Һ��������ӵ����ʵ����Ĺ�ϵͼ��ȷ���� ( )
��Fe2����Br����I����0.1 mol����Һ��ͨ���״���µ�Cl2��ͨ��Cl2���������Һ��������ӵ����ʵ����Ĺ�ϵͼ��ȷ���� ( )

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�������ʯ���ѽ�IJ�����ǣ� ��
A.C2H4B.C4H10C.C8H16D.C16H34
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Ti)����Ӳ�ȴ��۵�ߡ�����ʱ����ʴ�����ʱ��㷺���ڸ��¿Ƽ����Ϻͺ��������С������ᷨ�������ѵ�ԭ����������[��Ҫ�ɷ�������������FeTiO3��������Fe(��)������]��ͬʱ��ø���Ʒ�Ĺ�ҵ�����������£�
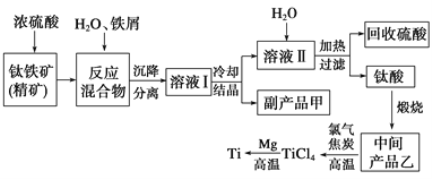
��1��Ũ���ᴦ��������ʱ����֮һ��TiOSO4����Ӧ��������ų���д���÷�Ӧ�Ļ�ѧ����ʽ___��
��2���������������м�����м��Ŀ����_______________����ѭ�����õ�������_________�����鸱��Ʒ���Ƿ���ʵ�ʵ�鷽����_________________________________��
��3����Һ���к���Fe2+��TiO2+������Mg2+�������ӡ������£����Ӧ���������Ksp���±���ʾ��
�������� | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0��10-16 | 1.0��10-29 | 1.8��10-11 |
�ٳ����£���������Һ��Mg2+�����ʵ���Ũ��Ϊ0.0018mol/L����pH����_________ʱ��Mg(OH)2��ʼ������
����������Fe2+��TiO2+��Mg2+����Һ��ˮϡ�ͣ���������������ɫ�������ó�����_______________________________________��
��4���м��Ʒ����һ��������侭��������������̿��Ӧ��������TiCl4�⣬��������һ�ֿ�ȼ�����壬��д���÷�Ӧ�Ļ�ѧ����ʽ___________��
��5��Mg��ԭTiCl4�����б�����1070K���¶��½��У�����Ϊ��ԭ���Ƶķ�Ӧ������__________________________________����Ӧ��IJ�����Ҫ����______________�ܽ����ܴﵽ�ᴿ�����ѵ�Ŀ�ġ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com