
����Ŀ��������(Ti)����Ӳ�ȴ��۵�ߡ�����ʱ����ʴ�����ʱ��㷺���ڸ��¿Ƽ����Ϻͺ��������С������ᷨ�������ѵ�ԭ����������[��Ҫ�ɷ�������������FeTiO3��������Fe(��)������]��ͬʱ��ø���Ʒ�Ĺ�ҵ�����������£�
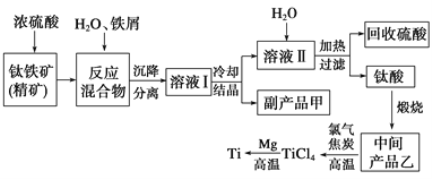
��1��Ũ���ᴦ��������ʱ����֮һ��TiOSO4����Ӧ��������ų���д���÷�Ӧ�Ļ�ѧ����ʽ___��
��2���������������м�����м��Ŀ����_______________����ѭ�����õ�������_________�����鸱��Ʒ���Ƿ���ʵ�ʵ�鷽����_________________________________��
��3����Һ���к���Fe2+��TiO2+������Mg2+�������ӡ������£����Ӧ���������Ksp���±���ʾ��
�������� | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0��10-16 | 1.0��10-29 | 1.8��10-11 |
�ٳ����£���������Һ��Mg2+�����ʵ���Ũ��Ϊ0.0018mol/L����pH����_________ʱ��Mg(OH)2��ʼ������
����������Fe2+��TiO2+��Mg2+����Һ��ˮϡ�ͣ���������������ɫ�������ó�����_______________________________________��
��4���м��Ʒ����һ��������侭��������������̿��Ӧ��������TiCl4�⣬��������һ�ֿ�ȼ�����壬��д���÷�Ӧ�Ļ�ѧ����ʽ___________��
��5��Mg��ԭTiCl4�����б�����1070K���¶��½��У�����Ϊ��ԭ���Ƶķ�Ӧ������__________________________________����Ӧ��IJ�����Ҫ����______________�ܽ����ܴﵽ�ᴿ�����ѵ�Ŀ�ġ�
���𰸡� FeTiO3��2H2SO4(Ũ)=TiOSO4��FeSO4��2H2O ��ԭFe3+ ���� ȡ����������ˮ���μ�����KSCN��Һ������Һ������Ѫ��ɫ����ײ����� 10 TiO(OH)2 TiO2+2C+2Cl2==TiCl4+2CO �������������ڶ��������Χ�У� ϡ���ᣨ��ϡ���ᣩ
����������������Ҫ�ɷ��ǣ�FeTiO3������������Mn��Zn��Cr��Cu���ؽ���Ԫ�ؼ���ʯ�����ʣ��м���Ũ���ᣬFeTiO3������Ӧ��FeTiO3��2H2SO4(Ũ)=TiOSO4��FeSO4��2H2O ���������Ũ���ᷴӦ�IJ���֮һ��TiOSO4��������м���ɷ�ֹFe2����������Һ���к���FeSO4��TiOSO4����Һ����Ҫ����TiOSO4������ˮ�����ȿ�ˮ������H2TiO3�������տ�����TiO2����������̼��Ӧ������TiCl4��������������þ��Ӧ������Ti��
��1��Ũ���ᴦ��������ʱ����֮һ��TiOSO4����Ӧ��������ų����÷�Ӧ�Ļ�ѧ����ʽ��FeTiO3��2H2SO4(Ũ)=TiOSO4��FeSO4��2H2O����2��������Fe3����Ӧ����Fe2����������м���ɷ�ֹFe2�����������������������Ӧ������Ʒ����FeSO4��7H2O����ѭ�����õ����������ᣬ���鸱��Ʒ���Ƿ���ʵ�ʵ�鷽����ȡ����Ʒ����ˮ������KSCN��Һ��Ѫ��ɫ֤������Ʒ�ױ��ʣ�����Һ������Ѫ��ɫ����ײ���������3����Ksp[Mg��OH��2]=c��Mg2������c2��OH����=1.8��10-11����c��OH����=![]() ����c��H����=
����c��H����=![]() =10-10���ʴ�ʱpH=10������֪TiO2������ˮ���������ᣨTiO(OH)2�������������ӣ������ӷ���ʽΪ��TiO2��+2H2O�TTiO(OH)2��+2H������4���м������ΪTiO2��TiO2�뽹̿�������ڸ����·�����Ӧ�������Ȼ��Ѻ�һ����̼����Ӧ�ķ���ʽΪ��TiO2+2C+2Cl2==TiCl4+2CO����5��Ϊ��ֹ̼��������Ӧ��Ӧ�ɾ��������ȣ���Ӧ��IJ�����Ҫ����ϡ���ᣨ��ϡ���ᣩþ�ܽ����ܴﵽ�ᴿ�����ѵ�Ŀ�ġ�
=10-10���ʴ�ʱpH=10������֪TiO2������ˮ���������ᣨTiO(OH)2�������������ӣ������ӷ���ʽΪ��TiO2��+2H2O�TTiO(OH)2��+2H������4���м������ΪTiO2��TiO2�뽹̿�������ڸ����·�����Ӧ�������Ȼ��Ѻ�һ����̼����Ӧ�ķ���ʽΪ��TiO2+2C+2Cl2==TiCl4+2CO����5��Ϊ��ֹ̼��������Ӧ��Ӧ�ɾ��������ȣ���Ӧ��IJ�����Ҫ����ϡ���ᣨ��ϡ���ᣩþ�ܽ����ܴﵽ�ᴿ�����ѵ�Ŀ�ġ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X��Y��Z����Ԫ�أ�����Y��ZΪ������Ԫ�أ���XԪ�������ڱ��ĵ������ڣ�X�ĸ��������ӵ�ԭ�Ӻ�������Ų���믵�ԭ�Ӻ�������Ų���ͬ��Z��X��ԭ��������������ȣ�Y�������������ˮ��Һ���ʼ��ԣ����������Ħ�������ֱ���62g/mol��78g/mol����X��Y�����������ˮ��Һ�е��뵭����ɫ��Z���ʵ�ˮ��Һ����Һ����ɫ������ɫ���Իش�
��1��Ԫ�ط��ţ�X �� Y �� Z ��
��2��Y������������Ϊ�� �� д����������������ˮ��Ӧ�Ļ�ѧ����ʽ�� ��
��3��Z�ĵ�������ˮ���μӵ�X��Y�γɵĻ������ˮ��Һ�У��ɷ�����Ӧ���÷�Ӧ�����ӷ���ʽΪ ��
��4��д��Y��Z�γɵĻ�����ĵ���ʽ����Z���ʷ��ӵĵ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ�����ҹ��Ϸ������ı�ѩ�ֺ��У�ʹ����һ����ѩ��������Ҫ�ɷֵĻ�ѧʽΪXY2 �� Xԭ�ӵĽṹʾ��ͼΪ ![]() ��X����������Y�������ӵĵ��Ӳ�ṹ��ͬ��Ԫ��Z��W��Ϊ������Ԫ�أ�����ԭ�ӵ�������������������Ӳ�����2����Z��Y������Z��W���γ�һ��WZ2�ͷ��ӣ�
��X����������Y�������ӵĵ��Ӳ�ṹ��ͬ��Ԫ��Z��W��Ϊ������Ԫ�أ�����ԭ�ӵ�������������������Ӳ�����2����Z��Y������Z��W���γ�һ��WZ2�ͷ��ӣ�
��1��m= �� ����ѩ���Ļ�ѧʽΪ �� �õ���ʽ��ʾ����ѩ�������γɹ��̣� ��
��2��Z��WԪ�ص�����Ϊ�� ��
��3������˵����ȷ���� ��
A.XY2��WZ2��Ϊ���ӻ�����
B.XY2�����н������Ӽ���WZ2�н������Թ��ۼ�
C.H2Z��HY���ȶ���ǿ
D.X�������ӱ�Y�������Ӱ뾶��
��4�����л�ѧ���������ȷ���� ��
A.XY2�ĵ���ʽ��X2+[ ![]()
![]()
![]()
![]()
![]() ]2��
]2��
B.WZ2�Ľṹʽ��Z=W=Z
C.YԪ�صĵ�����H2Zˮ��Һ��Ӧ�����ӷ���ʽΪ��Y2+Z2���T2Y+Z��
��5����ѩ�Ļ�ѧ�ɷ���H2O��ˮ�ķе��H2Z�ķе�ߣ���ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�����Ŀ�dz��Ӵ����ɶ���ԭ����ɵģ�����˵����ȷ�е��ǣ� ��
A.̼ԭ�Ӽ���γɵ�����˫��������
B.̼����̼ԭ�ӿ��������ԭ�ӣ���ԭ���ţ��γɹ��ۼ�
C.̼�������ﶼ�dz��ȶ�
D.̼�����������γɸ���ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩȩ�ṹ��ʽΪCH=CH-CHO�����й��й����������в���ȷ���ǣ� ��
A.�ܷ���������Ӧ������������
B.��ʹ��ˮ������KMnO4��Һ��ɫ
C.��һ���������ܱ���������
D.��һ����������H2��Ӧ����1һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�˿������ǧ�����ʷ���Ļ����Ŵ�Ⱦ������ij���������������˿�������������Ҫ�ɷ���һ���Σ��ܴٽ���˿�����˿����������ˮ�����ȥ��ʹ˿����ɫ��ס��ʸ�������ɫ��������������������Ҫ�ɷֿ����ǣ� ��
A.��������B.�������C.�ռ�D.̼���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������AlN���������£�������������Ժõ��������ʣ����㷺Ӧ���ڵ��ӹ�ҵ���մɹ�ҵ��������һ�������£���������ͨ�����·�Ӧ�ϳɣ�
Al2O3+N2+3C ![]() 2AlN+3CO����������ȷ���ǣ� ��
2AlN+3CO����������ȷ���ǣ� ��
A.�ڵ������ĺϳɷ�Ӧ�У�N2�ǻ�ԭ����Al2O3������
B.�����������Ͻ��е�һ��
C.������Ӧ��ÿ����2molAlN��Nʧȥ6mol����
D.�������е�Ԫ�صĻ��ϼ�Ϊ��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������NH4Br�����ܱ������У���ij�¶��£��������п��淴Ӧ��NH4Br(s) ![]() NH3(g)��HBr(g) 2HBr(g)
NH3(g)��HBr(g) 2HBr(g) ![]() Br2(g)��H2(g)��2min���c(H2)��0.5mol/L��c(HBr)��4mol/L����������Ӧ������
Br2(g)��H2(g)��2min���c(H2)��0.5mol/L��c(HBr)��4mol/L����������Ӧ������![]() (NH3)��ʾ�����з�Ӧ������ȷ����
(NH3)��ʾ�����з�Ӧ������ȷ����
A��0.5mol/(L��min) B��2.5 mol/(L��min)
C��2 mol/(L��min) D��5 mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. 1 mol CO2 ������Ϊ44g/mol B. CO2��Ħ������Ϊ44g
C. 64g�����к���2mol�� D. NA��CO2��������gΪ��λ����CO2����Է�����������ֵ����ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com