
【题目】下列关于合金的叙述中正确的是( )
A.合金一定是由两种或多种金属熔合而成的
B.日常生活中用到的五角硬币属于铜合金
C.铝合金的硬度比铝的大,熔点比铝的高
D.商代的司母戊鼎是由纯铜打造而成的
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在下列条件下,两瓶气体所含的原子数一定相等的是
A.具有同质量、不同体积的N2O和CO2B.具有同温度、同体积的CO和N2
C.具有同体积、同密度的SO2和NO2D.具有同密度、不同质量的O2和O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定实验(如图)。
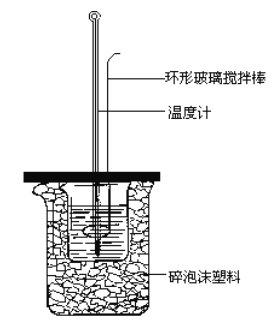
(1)量取反应物时,取50mL0.50mol·L-1的盐酸,还应加入的试剂是______(填序号)。
A.50mL0.50mol·L-1NaOH溶液 B.50mL0.55mol·L-1NaOH溶液 C.1.0gNaOH固体
(2)在实验过程中,该同学需要测定并记录的实验数据有____(填序号)。
A.盐酸的浓度 B.盐酸的温度 C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度E.水的比热容 F.反应后混合溶液的终止温度
(3)测得(1)放出1.43kJ的热量,则表示该反应中和热的热化学方程式是___________________________________。
(4)实验中若用60mL0.5mol·L-1盐酸溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量______ (填“相等”、“不相等”),所求中和热_______ (填“相等”、“不相等”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲.乙.丙.丁四种晶胞(如下图所示),可推知:甲晶体中A与B的离子个数比为________;乙晶体的化学式为_________;丙晶体的化学式为__________;丁晶体的化学式为________。
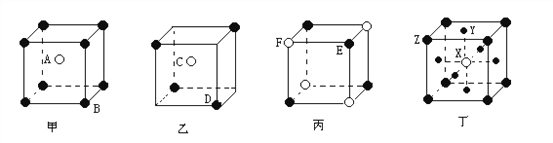
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 当光束通过稀豆浆时,会产生丁达尔效应
B. 因为SO2有漂白性,所以它可使高锰酸钾溶液褪色
C. 氯化钠溶液在电流作用下电离成Na+和Cl-
D. 等质量的碳酸钠和碳酸氢钠与足量盐酸反应时,碳酸钠产生的CO2多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.A、B、C、D四种均为含有钠元素的化合物,A、B、C与盐酸反应均可生成D;加热固体C可生成A和一种无色无味的气体X;在A溶液中通入足量X,又可生成C;B溶液和C溶液混合可生成A。请回答:
(1)B是___________,D是___________,(均用化学式表示)
(2)写出上述反应中由A生成C的化学方程式:____________________________________。
II.化合物甲仅含两种元素。B为黄绿色气体,气体D能使湿润的红色石蕊试纸变蓝色。在一定条件下有如下转化关系:
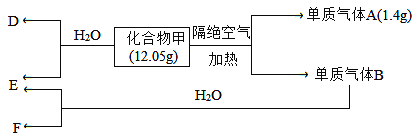
请回答:
(1)化合物甲所含元素为__________(填写元素符号),甲的化学式为___________________。
(2)气体B与水反应的离子方程式为____________________________________。
(3)甲与水反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
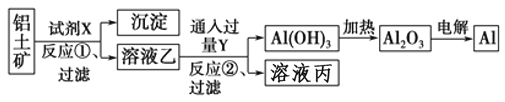
下列叙述正确的是
A. 按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氧化铁
C. 图中所有的转化反应都不是氧化还原反应
D. 反应②的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com