

分析 (1)该溶液的物质的量浓度=$\frac{1000ρω}{M}$;
(2)稀释100倍后,溶液中NaClO浓度应该是浓溶液的$\frac{1}{100}$,根据钠原子守恒计算稀释后钠离子浓度;
(3)根据次氯酸钠和二氧化碳反应方程式计算消耗二氧化碳体积;
(4)A.该实验中需要的仪器有托盘天平、玻璃棒、烧杯、容量瓶、胶头滴管;
B.容量瓶用蒸馏水洗净后,配制溶液时不需要烘干;
C.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少;
D.应选取500 mL的容量瓶进行配制,然后取出480 mL即可,根据m=cVM计算次氯酸钠质量;
(5)次氯酸钠和浓盐酸发生氧化还原反应生成氯气,氯气有毒.
解答 解:(1)该溶液的物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.192×25%}{74.5}$mol/L=4.0mol/L,故答案为:4.0;
(2)稀释100倍后,溶液中NaClO浓度应该是浓溶液的$\frac{1}{100}$,为0.04mol/L,根据钠原子守恒得c(Na+)=c(NaClO)=0.04mol/L,故答案为:0.04;
(3)一瓶“84消毒液”含有n(NaClO)=1 L×4.0 mol•L-1=4.0 mol,
根据反应CO2+NaClO+H2O═NaHCO3+HClO,则需要CO2的物质的量为n(NaClO)=4.0 mol,
即标准状况下V(CO2)=4.0 mol×22.4 L•mol-1=89.6 L,
故答案为:89.6;
(4)A.该实验中需要的仪器有托盘天平、玻璃棒、烧杯、容量瓶、胶头滴管,所以还需要两种玻璃仪器,故A错误;
B.容量瓶用蒸馏水洗净后,配制溶液时不需要烘干,因为留有的少量水不影响溶液配制,故B错误;
C.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;
D、应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol•L-1×74.5 g•mol-1=149 g,故D错误;
故选C;
(5)洁厕灵的主要成分是浓盐酸,次氯酸钠和浓盐酸发生氧化还原反应生成氯气,氯气有毒,所以会产生中毒现象,故答案为:二者混合会发生反应生成有毒气体氯气而使人中毒.
点评 本题以氯元素及其化合物为载体考查溶液配制、氯气性质、物质的量及物质的量浓度计算等知识点,为高频考点,侧重考查学生分析判断及计算能力,注意:次氯酸钠和二氧化碳、水反应生成碳酸氢钠而不是碳酸钠,为易错点.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
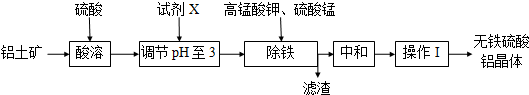
| 开始 | 完全 | |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.3 | 5.0 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 金 属 | 熔点(℃) | 沸点(℃) |
| 钙 | 841 | 1 487 |
| 镧 | 920 | 3 470 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可用作袋装食品干燥剂 | |
| B. | 纯净的SiO2可以制备光导纤维 | |
| C. | 硅酸盐一般易溶于水,化学性质很稳定 | |
| D. | 晶体硅是良好的半导体材料,可用于制造计算机芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
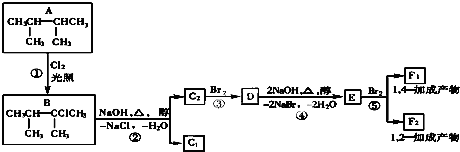
 .
. ,F1的结构简式是
,F1的结构简式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

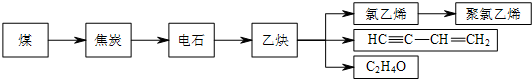
 ,随意丢弃聚氯乙烯制品会造成白色污染.
,随意丢弃聚氯乙烯制品会造成白色污染.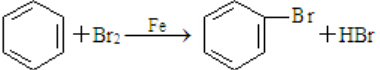 ,该反应中反应物溴应该选用液溴(填“溴水”或“液溴”).
,该反应中反应物溴应该选用液溴(填“溴水”或“液溴”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、NaOH | B. | H2、Al(OH)3 | C. | H2、NaCl、NaAlO2 | D. | H2、NaCl、Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
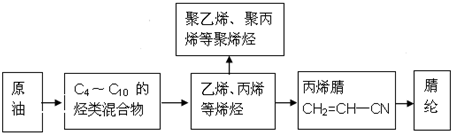
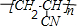 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com