
分析 (1)同周期自左而右金属性减弱,同主族自上而下金属性增强;
(2)①Be与Al的性质相似,则Be与NaOH溶液反应生成Be+2NaOH═Na2BeO2+H2↑;
②Be和Al位于对角线位置,性质相似,Be(OH)2与NaOH反应,而Mg(OH)2不能,则鉴别二者的试剂为NaOH溶液;
(3)融化状态下是否能够导电,导电为离子化合物,否则为共价化合物;
(4)元素周期表中某一元素具有如下性质:④其最高价氧化物对应的水化物既可以和酸反应,也可以和碱反应,1mol这种最高价氧化物对应的水化物最多消耗4mol/L 的盐酸1L,该元素处于IVA族,①该元素单质常被用作半导体材料,②其单质与稀盐酸不反应,与氢氧化钠溶液反应可以放出氢气,③其最高价氧化物既可以溶于浓盐酸,也可以溶于氢氧化钠溶液,处于金属与非金属交界处,故为Ge元素.
解答 解:(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故Cs>Na>Mg或Cs>Ba>Mg,故答案为:Na或Ba;
(2)①Be与Al的性质相似,则Be与NaOH溶液反应生成Be+2NaOH═Na2BeO2+H2↑,反应离子方程式为:Be+2OH-═BeO22-+H2↑,
故答案为:Be+2OH-═BeO22-+H2↑;
②Be(OH)2与NaOH反应,而Mg(OH)2不能,则鉴别二者的试剂为NaOH溶液,故答案为:NaOH溶液;
(3)融化状态下是否能够导电,导电为离子化合物,否则为共价化合物,
故答案为:融化状态下是否能够导电,导电为离子化合物,否则为共价化合物;
(4)元素周期表中某一元素具有如下性质:④其最高价氧化物对应的水化物既可以和酸反应,也可以和碱反应,1mol这种最高价氧化物对应的水化物最多消耗4mol/L 的盐酸1L,该元素处于IVA族,①该元素单质常被用作半导体材料,②其单质与稀盐酸不反应,与氢氧化钠溶液反应可以放出氢气,③其最高价氧化物既可以溶于浓盐酸,也可以溶于氢氧化钠溶液,处于金属与非金属交界处,处于第4周期第ⅣA族,为Ge元素,
故答案为:第4周期第ⅣA族.
点评 本题考查元素周期律的应用,侧重考查学生知识迁移应用与类比推理能力,难度中等.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在20g D2O中含有NA个氧原子 | |
| B. | 标准状况下,2.24 L三氧化硫中所含氧原子数为0.3 NA | |
| C. | 1 molCl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
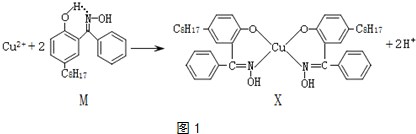
| 温度范围/℃ | 固体质量/g |
| 258~680 | 3.20 |
| 680~1000 | 1.60 |
| 1000以上 | 1.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 摩尔任何物质都含NA个原子 | |
| B. | 0.1 mol/L K2SO4溶液中含有 K+为0.2 NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA | |
| D. | 标准状况下,22.4L 以任意比混合的CO、CO2混合气体所含碳原子数约为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化,通常表现为热量的变化 | |
| B. | 反应物的总能量高于生成物的总能量时发生放热反应 | |
| C. | Ba(OH)2•8H2O与NH4Cl的反应是吸热反应 | |
| D. | 在化学反应中需要加热的反应就是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com