
| 开始 | 完全 | |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.3 | 5.0 |
| Mn2+ | 8.3 | 9.8 |
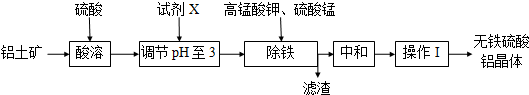
分析 工业生产无铁硫酸铝,以硫酸浸取铝土矿得含铁(Fe2+和Fe3+)的硫酸铝溶液,再加入铝土矿调节PH值至3,部分三价铁离子沉淀,再加入一定量高锰酸钾溶液和硫酸锰溶液,在溶液中生成活性二氧化锰,二价铁离子被氧化成三价铁,反应一段时间,Fe(OH)3和二氧化锰发生吸附共沉作用,最终得到无铁硫酸铝产品.
(1)加氢氧化钠和氧化钙会引入杂质且会将溶液中的金属离子沉淀下来;
(2)pH超过3.3将导致Al3+沉淀,降低成品产量;
(3)根据题中信息,可知操作1为蒸发浓缩,冷却结晶,过滤洗涤;
(4)根据表中数据可知,加入高锰酸钾的目的是把Fe2+转化为Fe3+,再调节PH值就可将铁除去;由题意可知高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,根据氧化还原反应中化合价升降相等,可写出化学方程式;
(5)铁离子易发生水解反应生成氢氧化铁,则滤渣的含铁成分是氢氧化铁;
(6)活性二氧化锰能吸附Fe(OH)3,促使Fe3+水解彻底.
解答 解:(1)为了不引入杂质用铝土矿,氢氧化钠和氧化钙会引入杂质且会将溶液中的金属离子沉淀下来,
故答案为:a;
(2)生产中控制pH为3而不大于3的原因是pH超过3.3将导致Al3+沉淀,降低成品产量,故答案为:pH超过3.3将导致Al3+沉淀,降低成品产量;
(3)根据题中信息,可知操作1为蒸发浓缩,冷却结晶,过滤洗涤;
故答案为:蒸发浓缩、冷却结晶、过滤洗涤;
(4)根据表中数据可知,除铁时,将二价铁转化成三价铁,再调节PH值就可将铁除去,否则在保留铝离子时,溶液中会存在二价铁,则加入高锰酸钾的目的是把Fe2+转化为Fe3+;由题意可知高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,根据氧化还原反应中化合价升降相等,可写出化学方程式为2KMnO4+3MnSO4+2H2O═5MnO2↓+2H2SO4+K2SO4,
故答案为:把Fe2+转化为Fe3+;2KMnO4+3MnSO4+2H2O═5MnO2↓+2H2SO4+K2SO4;
(5)铁离子易发生水解反应生成氢氧化铁,则滤渣的含铁成分是氢氧化铁,水解离子方程式为Fe3++3H2O?Fe(OH)3+3H+,
故答案为:Fe(OH)3;Fe3++3H2O?Fe(OH)3+3H+;
(6)活性二氧化锰能吸附Fe(OH)3,促使Fe3+水解彻底而充分沉淀(或促使水解平衡正向移动),
故答案为:吸附Fe(OH)3,促使Fe3+水解而充分沉淀(或促使水解平衡正向移动).
点评 本题考查较为综合,设计物质的制备流程、方程式的书写、氧化还原反应、物质的分离和提纯等问题,题目难度中等,注意把握制备原理和实验流程.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO3溶液中通入NH3至中性,溶液中存在:c(NH4+)>c(SO32-) | |
| B. | NH4Cl和NH3•H2O混合液pH=7,一定存在:c(NH4+)>c(Cl-) | |
| C. | NAHCO3溶液中存在HCO3-+H2O═H3O++CO32-,加水稀释后c(H+)减小 | |
| D. | pH相同的氯化铵与硫酸亚铁铵两种溶液中铵根离子浓度前者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在20g D2O中含有NA个氧原子 | |
| B. | 标准状况下,2.24 L三氧化硫中所含氧原子数为0.3 NA | |
| C. | 1 molCl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L己烷含有分子的数目为0.1NA | |
| B. | 原子结构示意图: 表示12C,也可以表示13C 表示12C,也可以表示13C | |
| C. | 0.1 mol/L Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 由离子方程式□□+XO3-+6H+=3X2+3H2O可判断X元素的最高化合价为+5价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体 | B. | 分子晶体 | C. | 离子晶体 | D. | 金属晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com