
【题目】9.6g 元素A与4.2g元素B含有相同的原子数,A和B原子核中质子数与中子数相等,已知A元素在其最高价氧化物中的含量是40%,在其氢化物中含量为94.1%。试计算A、B两元素的相对原子质量,并推算出它们在周期表中的位置。______________
【答案】A、B两元素的相对原子质量分别为:32、14,他们在周期表中的位置分别为:第三周期ⅥA族;第二周期VA族
【解析】
令A元素最高正化合价为a,则最低负化合价为(a-8),A的相对分子质量为b,
A元素最高价氧化物中A原子与O原子数目之比为2:a,由A元素在其最高价氧化物中的含量是40%,则2b:16a=40%:(1-40%),元素A的氢化物化学式为H(8-a)A,结合A元素质量分数可得:![]() =94.1%,联立方程,解得b=32,A原子核中质子数与中子数相等,相对原子质量-质子数+中子数,所以质子数为16,在周期表中第三周期ⅥA族;
=94.1%,联立方程,解得b=32,A原子核中质子数与中子数相等,相对原子质量-质子数+中子数,所以质子数为16,在周期表中第三周期ⅥA族;
令B元素相对分子质量为n,9.6g元素A与4.2g元素B含有相同的原子数,则![]() 解得n=14,B原子核中质子数与中子数相等,则B的质子数为7,为N元素,处于周期表中第二周期VA族。
解得n=14,B原子核中质子数与中子数相等,则B的质子数为7,为N元素,处于周期表中第二周期VA族。
【点晴】
掌握化学式中元素质量分数计算是解题的关键;A元素最高正化合价为a,则最低负化合价为(a-8),A的相对分子质量为b,其最高价氧化物中A原子与O原子数目之比为2:a,由A元素在其最高价氧化物中的含量是40%,则2b:16a=40%:(1-40%),元素A的氢化物化学式为H(8-a)A,结合A元素质量分数列方程,联立方程可得A元素相对分子质量,进而计算B的相对分子质量,A和B原子核中质子数与中子数相等,相对原子质量-质子数+中子数,求出各自的质子数,确定元素的种类以及他们在周期表中的位置。


科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E都含另外同一种元素。请回答:
(1)A是__________,Y是__________,Z是__________。
(2)当X是强酸时,E是__________;B生成C的化学方程式是________________________。
(3)当X是强碱时,E是__________; B生成C的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用酒精和84消毒液混合使用可能发生反应:4NaClO+CH3CH2OH![]() HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
A.含NA个ClO-的NaClO溶液中,Na+数目为NA
B.上述反应中,每生成1molNaCl,转移的电子数为8NA
C.100 g质量分数为46%的乙醇溶液中所含的氢原子数为6NA
D.标准状况下,2.24 L HCCl3含有的共用电子对的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,右图是元素周期表的一部分。
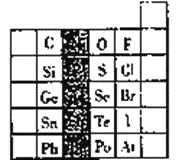
(1)阴影部分元素在元素周期表中的位置为第_________族。根据元素周期律、预测;酸性强弱H3AsO4______H3PO4(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度____________。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是__________
(4)下列说法正确的是__________
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究如下实验(A):
实验A | 条件 | 现象 |
| 加热 | i.加热后蓝色褪去 ii.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
(1)使淀粉变蓝的物质是____。
(2)分析现象i、ii认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动。
设计实验如下,“现象a”证实该分析不合理:

“现象a”是____。
(3)再次分析:加热后单质碘发生了变化,实验如下:
I:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝。
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝。
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释:______________。
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如下实验:

①产生黄色沉淀的离子方程式是____。
②Ag2O的作用是____________。
③依据上述实验,推测滤液中含有的物质(或离子)可能是_________。
(5)结合化学反应速率解释实验A中现象i、现象iii蓝色褪去的原因:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1=+216.4kJ/mol
CO(g)+3H2(g) H1=+216.4kJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=–41.2kJ/mol
CO2(g)+H2(g) H2=–41.2kJ/mol
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)H=__。
CO2(g)+4H2(g)H=__。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是__(填序号)。
A.N2和H2的转化率相等
B.反应体系密度保持不变
C.![]() 保持不变
保持不变
D.![]() =2
=2
②P1__P2(填“>”“<”“=”或“不确定”,下同);反应的平衡常数:B点__D点。
③C点H2的转化率为__;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:v(A)___v(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。

(3)已知阴极室溶液呈酸性,则阴极的电极反应式为__。反应过程中通过质子交换膜(ab)的H+为2mol时,吸收柱中生成的气体在标准状况下的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的叙述正确的是

A.图1中,Zn—MnO2干电池放电时,MnO2被氧化
B.图2中,电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等
C.图3中,K分别与M、N连接,均可保护Fe电极,连接M时称为“牺牲阳极的阴极保护法”
D.图4中,在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl7-形式存在,则阳极反应式为:Al -3e-+7AlCl4-= 4Al2Cl7-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是重要的过渡元素。
(1)钴位于元素周期表中第___族,基态钴原子中未成对电子的个数为_____。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中中心离子Fe3+的核外价电子排布式为___;尿素分子中氮原子的杂化方式是___,尿素中所含非金属元素的电负性由大到小的顺序是___。
(3)Co(NH3)5BrSO4可形成两种结构的钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:
在第一种配合物溶液中加硝酸银溶液产生白色沉淀。
在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀,则第二种配合物的配体为_____。
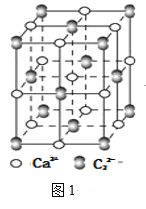
(4)离子化合物CaC2的一种晶体结构如图1所示,从钙离子看,属于____堆积,其配位数是_____;一个晶胞中平均含有的π键的个数为_____。
(5)科学研究结果表明。碳的氧化物CO2能够与H2O借助于太阳能制备HCOOH,其反应原理如下:2CO2+2H2O=2HCOOH+O2,则生成的HCOOH分子中σ键和π键的个数比是____。
(6)奥氏体是碳溶解在γ-Fe中形成的一种间隙固溶体,无磁性,其晶胞如图2所示,则该物质的化学式为______,若晶体密度为ρg/cm3,则晶胞中最近的两个碳原子的距离为_____pm(阿伏加德罗常数的值用NA表示,写出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com