
| A、2(x+n) | B、2(x-n) |
| C、2x | D、n+2x |
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+═Cu+2Na+ |
| B | 稀硫酸加入Ba(OH)2溶液至中性 2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | NaHSO4溶液加入Ba(OH)2溶液至中性 H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| C | 向氯化铝溶液中加入足量NaOH溶液 Al3++4OH-═AlO2-+2H2O | 向氯化铝溶液中加入足量氨水 Al3++4NH3?H2O═AlO2-+2H2O+4NH4+ |
| D | 向Ca(OH)2溶液中通入过量CO2 CO2+OH-═HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2+OH-═HSO3- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO的燃烧热为283kJ |
| B、2Na2O2(s)+2CO2(s)=2Na2CO3(g)+2O2(g);△H3>-452kJ?mol-1 |
C、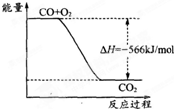 如图可表示由CO生成CO2的反应过程和能量关系 |
| D、CO(g)与Na2O2 (s)反应放出509kJ热量时,电子转移数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、⑥⑧ |
| C、②⑥⑦ | D、③⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
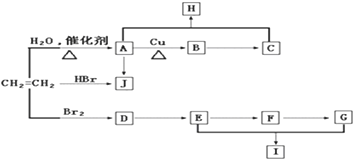
查看答案和解析>>
科目:高中化学 来源: 题型:
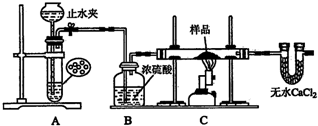 某红色固体粉末样品可能含有Fe2S3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究,探究方案设计如下:
某红色固体粉末样品可能含有Fe2S3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究,探究方案设计如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com