
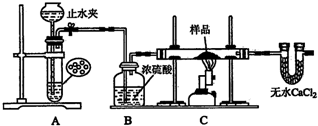
 某红色固体粉末样品可能含有Fe2S3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究,探究方案设计如下:
某红色固体粉末样品可能含有Fe2S3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究,探究方案设计如下:| 3.2g |
| 64g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
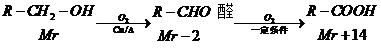
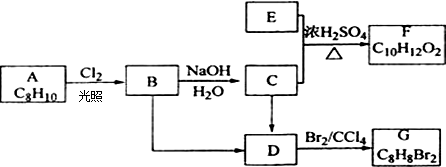
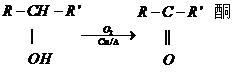 (酮中R、R′代表烃基且酮不能再被氧化为羧酸,其它物质中R、R′代表烃基或氢原子)
(酮中R、R′代表烃基且酮不能再被氧化为羧酸,其它物质中R、R′代表烃基或氢原子)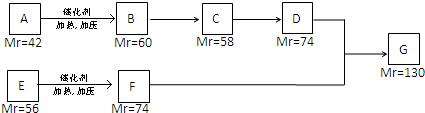
查看答案和解析>>
科目:高中化学 来源: 题型:
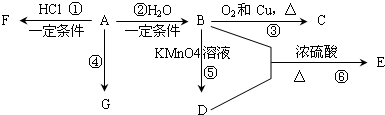
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
| ③ |
| ④ |
| ⑤ |
| H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将空气通过灼热的铜网可以除去O2 |
| B、用点燃的方法可以除去CO2中的CO |
| C、pH试纸使用前,先用蒸馏水湿润,再测定未知溶液的pH |
| D、稀释浓硫酸时,向浓硫酸中缓缓加入蒸馏水,用玻璃棒搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
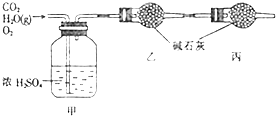
| 实验前 | 实验后 | |
| 甲的质量/g | 101.1 | 103.8 |
| 乙的质量/g | 82.0 | 86.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com