
| A、分子中共价键键角均为60° |
| B、黄砷中共价键键能大于白磷 |
| C、分子中含有的共价键的数目都是4 |
| D、黄砷的熔点低于白磷 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
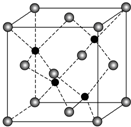 X、Y、Z、R、Q为前四周期元素,且原子序数依次增大,其中Y原子核外2p能级上有1个电子,R原子L层上有2对成对电子,X与Z可形成共价化合物ZX3,Q原子在第四周期中未成对电子数最多.请回答下列问题:
X、Y、Z、R、Q为前四周期元素,且原子序数依次增大,其中Y原子核外2p能级上有1个电子,R原子L层上有2对成对电子,X与Z可形成共价化合物ZX3,Q原子在第四周期中未成对电子数最多.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、绿色食品是指不含任何化学物质的食品 |
| B、硅是制造太阳能电池的常用材料 |
| C、SiO2、SO2均属酸性氧化物 |
| D、光导纤维是以二氧化硅为主要原料制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸的质量增加 |
| B、铝的表面生成致密的氧化物薄膜 |
| C、澄清的石灰水变浑浊 |
| D、氢氧化钠固体发生潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2是氧化产物,KCl是还原产物 |
| B、盐酸在该反应中只表现还原性 |
| C、每生成3 mol Cl2,有1 mol KClO3发生氧化反应 |
| D、每转移0.1 mol电子,能生成标准状况1344mLCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
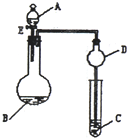 用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
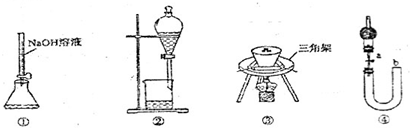
| A、用装置①量取15.00mL的NaOH溶液 |
| B、用装置②分离苯和水的混合物,苯应从下口流出 |
| C、用装置③陶瓷坩埚高温煅烧CaCO3固体 |
| D、关闭活塞a,从b处加水,以检查装置④的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com