
【题目】(1)阿伏加德罗常数为NA mol-1。现有某气体,它的摩尔质量是M g·mol-1,在t ℃ 1.01×105 Pa时,气体摩尔体积为Vm L·mol-1。取t ℃、1.01×105Pa时此气体m g。回答下列问题:
①该气体一个分子的质量为________g;
②m g该气体中所含的微粒数目为________个;
③t ℃、1.01×105Pa时,m g该气体的体积为______L。
④t ℃、1.01×105Pa时,该气体与氢气的密度比为__________________
(2)食盐水中分离出固体的方法是________,实验中玻璃棒的作用是_________________ 。把汽油和水分离使用到的一种玻璃仪器名称是__________________________
【答案】M/NA m×NA/M m×Vm/M M:2 蒸发结晶 搅拌,使液体受热均匀 分液漏斗
【解析】
(1)利用n=![]() =
=![]() =
=![]() 进行计算;
进行计算;
(2)分离食盐水中的NaCl,用蒸发结晶;玻璃棒搅拌加速水的蒸发,且使溶液受热均匀;分离两种互不相溶的液体采用分液的方式。
(1)①某气体的摩尔质量是M g·mol-1,1mol的质量为Mg,分子个数为NA,则一个分子的质量为M/NAg;
②n=m/M,N=n×NA=m×NA/M;
③V=n×Vm=m×Vm/ML;
④同温同压下,相对密度之比等于摩尔质量之比,该气体与氢气的密度比为M:2;
(2)食盐水中分离出NaCl固体,可用蒸发结晶、过滤的方式分离;玻璃棒搅拌加速水的蒸发,且使溶液受热均匀;分离两种互不相溶的液体采用分液的方式,装置为分液漏斗。


科目:高中化学 来源: 题型:
【题目】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。
(1)升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g) ![]() 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
I.2NO(g) ![]() N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g) ![]() 2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
请回答下列问题:
①反应2NO(g)+O2(g) ![]() 2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
②决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
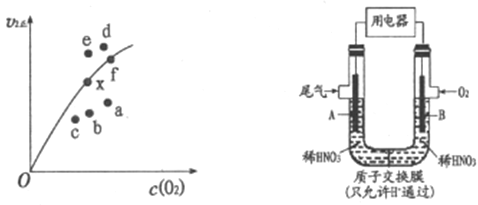
(2)通过图所示装置,可将汽车尾气中的NO、NO2转化为重要的化工原料HNO3,其中A、B为多孔惰性电极。该装置的负极是__________ (填“A”或“B”),B电极的电极反应式为__________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液甲,溶液乙为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c (NO2-)和c(CH3COO-)由大到小的顺序为__________(已知HNO2的电离常数Kα=7.1×10-4mol/L,CH3COOH的电离常数Kα=1.7×10-5mol/L)。可使溶液甲和溶液乙的pH相等的方法是__________。
a.向溶液甲中加适量水 b.向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物含有4个C,每个C原子都以键长相等的三条单键连接3个C,且整个结构中所有碳碳键之间的夹角都为60°,则下列说法不正确的是 ( )
A. 该有机物的分子式为C4H4B. 该有机物不存在
C. 该有机物的空间构型为正四面体D. 该有机物不属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。研究发现青蒿素中的某个基团对热不稳定,该基团还能与NaI作用生成I2。下列分析不正确的是

A. 推测青蒿素在乙醚中的溶解度小于在水中的溶解度
B. 通过元素分析与质谱法可确认青蒿素的分子式
C. 青蒿素中含有的 “![]() ” 基团是酯基
” 基团是酯基
D. 青蒿素中对热不稳定且具有氧化性的基团是“—O—O—”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O4﹣+ H+ Ka1 ; HC2O4﹣
HC2O4﹣+ H+ Ka1 ; HC2O4﹣![]() C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A. T℃时,lgKa2=-4.2
B. pH=1.2溶液中:c(K+)+c(H+)=c(OH﹣)+c(H2C2O4)
C. pH=2.7溶液中:![]()
D. 向pH=1.2的溶液中再加KOH溶液,将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g)![]() 2NH3(g),△H<0,在673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )
2NH3(g),△H<0,在673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )

A. 点a的正反应速率比点b的大
B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D. 其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,充入时体积如图所示,若将装置右边H2、O2的混合气体点燃引爆,活塞先左弹,恢复至原温度后,活塞右滑最终停在容器的正中央,则原来H2、O2的体积比最接近于( )

①2∶7 ②5∶4 ③4∶5 ④7∶2
A. ①② B. ②④ C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去)。已知A、B均为由相同的两种元素组成的无色液体,C、E、G、I均为无色气体,其中C为单质,E为最简单的烃,G能使澄清石灰水变浑浊,I能使品红褪色;D、E均由两种元素组成,D的摩尔质量为144g·mol-1,H中两种元素质量比为7∶8,F是白色胶状沉淀,J是红棕色固体。

(1)G的电子式为_____。
(2)H的化学式为_____。
(3)写出反应①的化学方程式:______。
(4)写出反应②的离子方程式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com