
【题目】(1)聚碳酸酯 的透光性良好,可制作车、船、飞机的挡风玻璃,以及眼镜镜片、光盘、唱片等,原来合成碳酸酯的一种原料是用有毒的光气,现在改用绿色化学原料碳酸二甲酯
的透光性良好,可制作车、船、飞机的挡风玻璃,以及眼镜镜片、光盘、唱片等,原来合成碳酸酯的一种原料是用有毒的光气,现在改用绿色化学原料碳酸二甲酯 与某物质缩合聚合,该物质属于(______)类
与某物质缩合聚合,该物质属于(______)类
A.二卤化物 B.二醇类 C.二醛类 D.二酚类
(2)硅橡胶具有无毒、无味、耐高温又耐低温,可制成耐温垫圈、密封件和人造心脏、人造血管等.它是由单体二甲基二氯硅烷(CH3)2SiCl2水解得到二甲基硅二醇,经脱水缩聚成的聚硅氧烷再经交联制成的.请用化学方程式写出上述二甲基二氯硅烷水解及线型缩聚的过程.
水解方程式为____________________________________________________
缩聚反应方程式为_______________________________________________
(3)硝酸甘油又叫三硝酸甘油酯,由1mol甘油和3mol HNO3在浓硫酸、加热条件下酯化生成,是临床上常用的抗心率失常药。该药可以丙烯为原料合成制得,其合成步骤如下:
1-丙醇![]() 丙烯
丙烯![]()
![]() 1,2,3-三氯丙烷
1,2,3-三氯丙烷![]()
![]() 三硝酸甘油酯
三硝酸甘油酯
( 提示:CH2= CHCH3 + C12 ![]() CH2= CHCH2C1+ HC1 )
CH2= CHCH2C1+ HC1 )
i:反应②的产物是_______________,反应④的产物是______________(均写结构简式)。
ii:写出③的化学方程式____________________________________
iii:如果在制取丙烯时所用的1-丙醇中混有2-丙醇,对所制丙烯的纯度有无影响? 请简要说明理由_____________________________________________________________ 。
【答案】D (CH3)2SiCl2+2H2O→(CH3)2Si(OH)2+2HCl n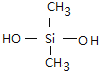
![]()
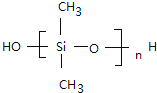 CH2=CHCH2Cl CH2OHCHOHCH2OH
CH2=CHCH2Cl CH2OHCHOHCH2OH ![]() 如果在制取丙烯时所用的1-丙醇中混有2-丙醇,对所制丙烯的纯度没有影响,因为二者在发生消去反应时的产物都是丙烯
如果在制取丙烯时所用的1-丙醇中混有2-丙醇,对所制丙烯的纯度没有影响,因为二者在发生消去反应时的产物都是丙烯
【解析】
(1)分析聚碳酸酯水解产物,可得出结论;
(2)二甲基二氯硅烷(CH3)2SiCl2,水解得到(CH3)2Si(OH)2和HCl;(CH3)2Si(OH)2发生缩聚反应生成聚硅氧烷,根据反应物和生成物书写方程式;
(3)1-丙醇在浓硫酸作用下发生消去反应生成丙烯(CH3CH=CH2)在加热条件下发生取代反应生成;CH2=CHCH2Cl,然后与氯气发生加成反应可生成ClCH2CHClCH2Cl,在碱性条件下水解生成HOCH2CHOHCH2OH,进而与硝酸发生酯化反应可生成三硝酸甘油酯,结合对应物质的结构和性质以及题目要求可解答该题。
(1)聚碳酸酯,发生水解得聚二酚化合物与碳酸二甲酯,故聚碳酸酯是由碳酸二甲酯与二酚类缩合聚合而成;
本题答案为D;
(2)二甲基二氯硅烷(CH3)2SiCl2水解得到![]() 和HCl,反应方程式为:
和HCl,反应方程式为:![]() →
→![]() ;
;
![]() 发生缩聚反应生成聚硅氧烷,反应方程式为:n
发生缩聚反应生成聚硅氧烷,反应方程式为:n![]()
![]()
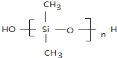 ;
;
本题答案为:![]() →
→![]() ;
;
n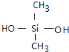
![]()
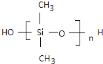 ;
;
(3)①为1-丙醇在浓硫酸作用下发生消去反应生成丙烯方程式为
![]() ;
;
②为丙烯在加热条件下发生取代反应生成CH2=CHCH2Cl,方程式为:
![]() ;
;
③为CH2=CHCH2Cl与氯气发生加成反应可生成ClCH2CHClCH2Cl方程式为:
CH2=CHCH2Cl+Cl2→ClCH2CHClCH2Cl;
④为ClCH2CHClCH2Cl,在碱性条件下水解生成HOCH2CHOHCH2OH,方程式为:
![]() ;
;
⑤是生成三硝酸甘油酯的反应,HOCH2CHOHCH2OH+3HNO3→O2NOCH2CHONO2CH2ONO2+3H2O
本题答案为:CH2=CHCH2Cl,CH2OHCHOHCH2OH;CH2=CHCH
如果在制取丙烯时所用的1-丙醇中混有2-丙醇,对所制丙烯的纯度没有影响,因为二者在发生消去反应时的产物都是丙烯。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g),下列叙述中不正确的是( )

A. Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有32.5g锌溶解时正极放出11.2 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三瓶等体积、等物质的量浓度的NaOH溶液,若甲不变,将乙蒸发掉一半水(溶质不析出),丙中通入一定量的CO2 。然后以甲基橙作指示剂,用相同浓度的盐酸滴定,分别达到终点消耗盐酸的体积是
A. V甲=V乙>V丙 B. V丙>V乙>V甲 C. V乙>V丙>V甲 D. V甲=V乙=V丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应或离子反应方程式正确的是
A. 苯与溴水反应:2![]() +Br2
+Br2![]()
B. 1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH= CH3CH=CH2↑+NaCl+H2O
C. 苯酚钠溶液中通入少量CO2:C6H5O-+H2O+CO2→C6H5OH+HCO3-
D. 实验室制取乙炔的反应:CaC2+H2O → CaO + CH≡CH↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:已知MgCl2·6H2O受热时发生水解:MgCl2·6H2O=Mg(OH)Cl+HCl↑+5H2O,而MgSO4·7H2O受热不易发生水解。试解释原因_______________________________________
II:卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若用它以及表2中的某些物质为原料,按图所示工艺流程进行生产,可制得轻质氧化镁.

若要求产品尽量不含杂质,且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2* | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
表2原料价格表
物质 | 价格(元吨-1) |
漂液(含25.2% NaClO) | 450 |
双氧水(含30% H2O2) | 2400 |
烧碱(含98% NaOH) | 2100 |
纯碱(含99.5% Na2CO3) | 600 |
* Fe(OH)2呈絮状不易从溶液中除去,所以常将Fe2+氧化为Fe3+,生成Fe(OH)3沉淀除去.
(1)在步骤②中加入的试剂X,最佳的选择是___________,写出步骤②中pH=1时所发生反应的离子方程式:____________________________________________;
(2)在步骤③中加入的试剂是______________________;之所以要控制pH=9.8,其目的是______________________________________________________;
(3)某燃料电池的燃料为CO,电解质为熔融态的试剂Z(步骤④中加入试剂的有效成分),则该燃料电池的正极电极反应方程式为:____________________;
(4)在步骤⑤中发生的反应是____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有甲、乙、丙三种物质:
甲![]() 乙
乙 ![]()
分子式 | C9H8O |
部分性质 | 能使Br2/CCl4褪色 |
丙
(1)乙中含有的官能团的名称为_______________;
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
![]()
其中反应II的条件是___,反应III的化学方程式为______(不需注明反应条件);
(3)由甲出发合成丙的路线之一如下:

(a)写出反应③化学方程式________;
(b)丙的结构简式为_______________;
(c)D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式_______。
a.苯环上的一氯代物有两种
b.在空气中易被氧化,遇FeCl3溶液显紫色
c.能与Br2/CCl4发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫、氮气、二氧化碳组成的混合气体在同温、同压下与笑气(N 2O)的密度相同,则该 混合气体中二氧化硫、氮气、二氧化碳的质量比为( )
A. 4:5:6 B. 22:1:14
C. 64:35:13 D. 29:8:13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长征2号火箭承担运载“神六”的使命。氢化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭发射的优良炸药。下列说法正确的是( )
A. LiH、LiD、LiT的摩尔质量之比为1:2:3
B. 它们互称同分异构体
C. H、D、T之间互称同素异形体
D. 它们都是强还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极)。下列分析正确的是)

A. 电子流动方向为a→导线→b
B. H+经质子交换膜由右向左移动
C. 放电一段时间b极附近pH不变
D. a电极发生反应:H2N(CH2)2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com