
【题目】a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层电子数相同,c所在周期数与族序数相同;d与a同族,下列叙述正确的是( )
A.四种元素中b的金属性最强
B.原子半径:![]()
C.d的单质氧化性比a的单质氧化性强
D.c的最高价氧化物对应水化物是一种强碱
【答案】A
【解析】
a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同,则a的核外电子总数应为8,为O元素;则b、c、d为第三周期元素,c所在周期数与族数相同,应为Al元素,d与a同族,应为S元素,b可能为Na或Mg,结合对应单质、化合物的性质以及元素周期律解答该题。
由以上分析可知:a为O元素、b可能为Na或Mg、c为Al、d为S元素。
A.同周期元素从左到右元素的金属性逐渐降低,则金属性b>c,a、d为非金属,金属性较弱,则4种元素中b的金属性最强,选项A正确;
B.同周期元素从左到右原子半径逐渐减小,应为b>c>d,a为O,原子半径最小,选项B错误;
C.一般来说,元素的非金属性越强,对应的单质的氧化性越强,应为a的单质的氧化性强,选项C错误;
D.c为Al,对应的最高价氧化物的水化物为氢氧化铝,为弱碱,选项D错误;
故选:A。


科目:高中化学 来源: 题型:
【题目】粮食仓储常用磷化铝(AlP)熏蒸杀虫,AlP遇水即产生强还原性的PH3气体。国家标准规定粮食中磷化物(以PH3计)的残留量不超过0.05mg·kg-1时为合格。某小组同学用图所示实验装置和原理测定某粮食样品中磷化物的残留量。C中加入100g原粮,E中加入20.00mL 2.50×10-4mol·L-1KMnO4溶液(H2SO4酸化),C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中的溶液。
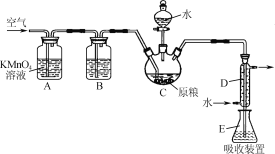
(1)装置A中的KMnO4溶液的作用是________。
(2)装置B中盛装焦性没食子酸的碱性溶液吸收空气中的O2。若去掉该装置,则测得的磷化物的残留量________(填“偏高”“偏低”或“不变”)。
(3)装置E中PH3被氧化成磷酸,MnO4-被还原为Mn2+,写出该反应的离子方程式:________。
(4)收集装置E中的吸收液,加水稀释至250mL,量取其中的25.00mL于锥形瓶中,用4.0×10-5 mol·L-1的Na2SO3标准溶液滴定,消耗Na2SO3标准溶液20.00 mL,反应原理是SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平)。通过计算判断该样品是否合格(写出计算过程)。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种无色溶液,它们分别是葡萄糖溶液、蔗糖溶液、淀粉溶液中的一种,某同学做实验得出:
①B能发生银镜反应;②A遇碘水变蓝色;③A、C均能发生水解反应,水解液均能发生银镜反应。
回答下列问题:
(1)写出各物质的名称:
A是________,B是________,C是________。
(2)写出有关化学反应方程式:
①蔗糖水解:__________________________________________。
②淀粉水解:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为了证明、比较SO2和氯水的漂白性,设计了如图所示的实验装置。

(1)实验室常选用KMnO4和浓盐酸制Cl2;选用Cu和浓硫酸反应制取SO2时,其中制SO2应选用如图A、E两发生装置中___装置(填装置序号),反应的化学方程式为___。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:___,D:___。
(3)甲乙两名同学分别利用如图所示装置探究两种气体按不同比例混合后的漂白性。

试
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:___。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:___(结合反应方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是

A. 若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
B. 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
C. 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D. 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:υ(H2)=1 mol·L-1·min-1;乙:υ(N2)=2 mol·L-1·min-1;丙:υ(NH3)= 3 mol·L-1·min-1。则三个容器中合成氨的反应速率
A. υ(甲)>υ(乙)>υ(丙) B. υ(乙)>υ(丙)>υ(甲)
C. υ(丙)>υ(甲)>υ(乙) D. υ(乙)>υ(甲)>υ(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2升的密闭容器中,发生以下反应:2A(g)+ B(g)![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.16 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.16 mol/(L·s),则10秒钟时,容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸二甲酯(DMF)俗称防霉保鲜剂霉克星1号,曾广泛应用于化妆品、蔬菜、水果等防霉、防腐、防虫、保鲜,它的一条合成路线如图所示。

回答下列问题:
(1)B的结构简式为______,D中官能团名称______。
(2)①的反应的类型是______,②的反应条件是______。
(3)④的反应方程式为______。
(4)写出C的一种同分异构体,满足可水解且生成两种产物可相互转化______。
(5)过程③由多个步骤组成,写出由C→D的合成路线_____。(其他试剂任选)(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法正确的是
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com