
【题目】“碳化学”是绿色化学的重要组成部分。
(1)由CO2制备甲醇的过程发生的主要反应如下:
反应I: CO2(g)+ 3H2(g) ![]() CH3OH(g)+ H2O(g) △H 1<0;
CH3OH(g)+ H2O(g) △H 1<0;
向2 L恒容密闭容器中充入3molH2和1.5molCO2,在一定条件下该反应l0min时达到平衡状态,二氧化碳的转化率a(CO2)=60%,则v(H2) =_________________________。(填字母)。
若要同时提高反应速率和甲醇的产量,以下措施一定可行的是
a.升高温度 b.缩小容器体积 c.分离出甲醇 d.增加CO2的浓度
(2)已知: CO2(g)+ 2H2(g)![]() C(s)+ 2H2O(g) △H =-90.0kJ/mol ;H2O(1)=H2O(g) △H =+44.0kJ/mol; C(s)的燃烧热为394.0kJ/mol。则H2的燃烧热为_________kJ/mol。
C(s)+ 2H2O(g) △H =-90.0kJ/mol ;H2O(1)=H2O(g) △H =+44.0kJ/mol; C(s)的燃烧热为394.0kJ/mol。则H2的燃烧热为_________kJ/mol。
(3)在某条件下,将4molH2和1molCO2,置于2L密闭容器中发生反应:
反应II :CO2(g)+4H(g) ![]() CH4(g)+2H2O(g) △H2
CH4(g)+2H2O(g) △H2
反应Ⅲ: CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
CO2转化率、CH4和CO 选择性随温度变化情况分别如图所示(选择性: 转化的CO2中生成CH4或CO 的百分比)。
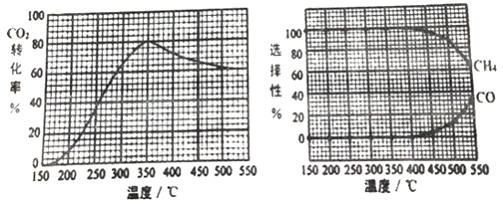
①反应II的△H2________(填“>”、“<“或“=")0,理由是_________________________。
②350℃时,反应II 的平衡常数K=_______。为减少CO 在产物中的比率,可采取______的措施有______(例举一例回答)。
【答案】 0.135mol·L-1·min-1 b d 286.0或ΔH =-286.0 < 平衡后升高温度,CO2的转化率降低,可知该平衡向逆反应方向移动,故该反应为放热反应 100 增大压强
【解析】(1) CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
起始(mol) 1.5 3 0 0
反应(mol)1.5×60% 3×1.5×60% 1.5×60% 1.5×60%
平衡(mol) 0.6 0.3 0.9 0.9
v(H2)= =0.135mol·L-1·min-1;a.升高温度,平衡逆向移动,甲醇的产量减少,错误;b.缩小容器体积,压强增大,反应速率增大,平衡正向移动,甲醇的产量增大,正确;c.分离出甲醇,甲醇的浓度减小,反应速率减慢,错误;d.增加CO2的浓度,反应速率增大,平衡正向移动,甲醇的产量增大,正确;故选bd,故答案为:0.135mol·L-1·min-1;b d;
=0.135mol·L-1·min-1;a.升高温度,平衡逆向移动,甲醇的产量减少,错误;b.缩小容器体积,压强增大,反应速率增大,平衡正向移动,甲醇的产量增大,正确;c.分离出甲醇,甲醇的浓度减小,反应速率减慢,错误;d.增加CO2的浓度,反应速率增大,平衡正向移动,甲醇的产量增大,正确;故选bd,故答案为:0.135mol·L-1·min-1;b d;
(2)①CO2(g)+2H2(g)C(s)+2H2O(g)△H=-90.0kJ/mol,②H2O(1)═H2O(g)△H=+44.0kJ/mol,C(s)的燃烧热△H=-394.0kJmol-1,故热化学方程式为③C(s)+O2(g)=CO2(g)△H=-394.0kJ/mol, ![]() ×①+
×①+![]() ×③-②得,H2(g)+
×③-②得,H2(g)+ ![]() O2(g)=H2O(l)△H=-286kJ/mol,故答案为:286或△H=-286;
O2(g)=H2O(l)△H=-286kJ/mol,故答案为:286或△H=-286;
(3)①反应II达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应,故<0;原因是反应Ⅰ达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应,故答案为:<;反应II达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应;
② CO2(g)+4H2(g)CH4(g)+2H2O(g)
开始(mol) 1 40 0
变化(mol)0.83.2 0.81.6
平衡(mol)0.20.8 0.8 1.6,
则c(CO2)= ![]() =0.1mol/L,c(H2)=
=0.1mol/L,c(H2)= ![]() =0.4mol/L,c(CH4)=
=0.4mol/L,c(CH4)= ![]() =0.4mol/L,c(H2O)=
=0.4mol/L,c(H2O)= ![]() =0.8mol/L,则K=
=0.8mol/L,则K=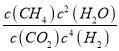 =
=![]() =100,由图像知,为减少CO在产物中的比率,可采取的措施有增加压强或降低温度,故答案为:100;增加压强。
=100,由图像知,为减少CO在产物中的比率,可采取的措施有增加压强或降低温度,故答案为:100;增加压强。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关1mol O2的说法中,不正确的是(NA表示阿伏伽德罗常数)( )
A.质量为32g
B.含氧原子数为NA
C.含氧分子数为NA
D.在标准状况下,体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是( )
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法中,正确的是( )
A.元素周期表有8个主族
B.元素周期表有7个周期
C.IA族的元素全部是金属元素
D.短周期是指第一、二周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
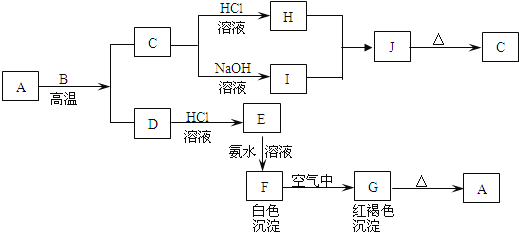
(1)写出下列物质的化学式:A:________,E:________,J:________,G:________.
(2)按要求写方程式:
①A与B在高温条件下生成C和D的化学方程式:________________________________;
②C转化为I的离子方程式:___________________________________________.
③F在空气中转化为G的化学方程式:__________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol/L NaOH溶液中加入0.2 mol/L CH3COOH溶液,所加入溶液的体积(v)和混合液中pH变化关系的曲线如下图所示,若B点的横坐标a=10,下列分析的结论正确的是( )
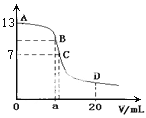
A. 在B点有:c(Na+)=c(CH3COO-)
B. 对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D. D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
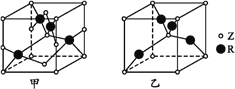
【题目】已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大。X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态。请回答下列问题:
(1)R基态原子的外围电子排布式为____,其基态原子有__种能量不同的电子。
(2)元素X、Y、Z的第一电离能由小到大的顺序为(用元素符号表示)____。
(3)与XYZ-互为等电子体微粒的化学式为______(写出一种即可),XYZ-的中心原子的杂化方式为_____。
(4)R2+与NH3形成的配离子中,提供孤对电子的原子是__。
(5)已知Z、R能形成两种化合物,其晶胞如图所示,甲的化学式为__,乙的化学式为__;高温时,甲易转化为乙的原因为_____________。
(6)若甲晶体中一个晶胞的边长为a pm,则甲晶体的密度为______g·cm-3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com