
【题目】标准状况下,a L氢气在过量的bL氯气中燃烧,所得混合物用100mL3.00mol·L-1的NaOH溶液恰好完全吸收,则氯气的体积b为( )
A. 2.24L B. 4.48L C. 3.36L D. 1.12L
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:

已知:铬元素在酸性条件下以重铬酸根离子的形式存在。回答下列问题:
(1)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4+Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_____________________________。
Na2CrO4+Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_____________________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________________(填“大”或“小”),原因是________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________ (填标号)得到的K2Cr2O7固体产品最多。
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。

(5)某工厂用m1kg铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品m2kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.现有四份体积、浓度均相等的AgNO3溶液,分别与等物质的量浓度的下列溶液恰好完全反应,所需溶液体积最小的是 ()
A.ZnCl2溶液B.NaCl溶液C.CaCl2溶液D.AlCl3溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能给合质子的分子或离子都是碱,按照这种理论下列物质既属于酸又属于碱的是 ( )
A. NaOH B. HCl C. NaH2PO4 D. Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的重要化合物如氨(NH3)、氮氧化物(NxOy)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)NH3催化氣化可制备硝酸。
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1=-907.28kJ·mol-1
4NO(g)+6H2O(g) △H1=-907.28kJ·mol-1
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2=-1269.02kJ·mol-1
2N2(g)+6H2O(g) △H2=-1269.02kJ·mol-1
则4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H3_____。
5N2(g)+6H2O(g) △H3_____。
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[a(NO)]与温度、压强的关系如下图所示。则p1____p2(填“><“或“=”);

③在500℃温度时,2L密闭容器中充入2molNO和1molO2,达平衡时压强为p2MPa。则500℃时该反
应的平衡常数Kp=______,(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为_____,消耗标准状况下4.48LNH3时,被消除的NO2的物质的量为______mol。

(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,
其电解原理如图所示。

①a电极为电解池的______(填“阴”或“阳”)极,写出该电极的电极反应式:_________;电解过程中
还会生成少量氧化性极强的气体单质,该气体的分子式是_________。
②已知同温时NH3·H2O的电离常数小于氢氟酸的电离常数,则0.1mo/LNH4F溶液中所有离子浓度由大到小的顺序为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京时间2015年10月5日,中国女科学家屠呦呦获诺贝尔医学奖,屠呦呦从中医古籍里得到启发,用乙醚从青蒿素提取出可以高效抑制疟原虫的成分——青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )

A. 青蒿素的分子式为C15H22O5
B. 青蒿素能与NaOH溶液反应
C. 青蒿素易溶于水、乙醇、苯等溶剂
D. 用乙醚从青蒿中提取青蒿素,用到了萃取的原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是()。

A. 汉黄芩素的分子式为C16H13O5
B. 该物质遇FeCl3溶液显色
C. 1 mol该物质与溴水反应,最多消耗1 mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯醇(CH2= CH-CH2OH)可发生的化学反应有 ( )
①加成 ②氧化 ③燃烧 ④取代
A.只有①②B.只有①②③C.只有①③D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓度均为0.1 mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg V/V0的变化关系如右图所示。下列叙述正确的是
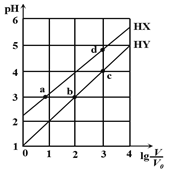
A. a、b两点的溶液中:c(X-)>c(Y-)
B. 相同温度下,电离常数K(HX):d>a
C. 溶液中水的的电离程度:d>c>b>a
D. lgV/V0=2时,若同时微热两种液体(不考虑挥发),则c(X-) /c(Y-) 增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com