
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用如图所示装罝制备NaNO2并对其性质作如下探究(A中加热装罝已略去)。

已知:
① 2NO+Na2O2=2NaNO2。
② NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。
③ 在酸性条件下,NaNO2能将I-氧化为I2;S2O32-能将I2还原为I-。
④ 在此条件下,Na2O2完全反应,无剩余。
【制备NaNO2】
(1) 装置A的三颈烧瓶中发生反应的化学方程式为_____________。
(2) 装置B中水和铜的作用分别是__________、__________。
(3) 为了保证制得亚硝酸钠的纯度,装置C中盛放的试剂可能是_________(填字母)。
A.P2O5 B.碱石灰 C.无水CaCl2 D.NaCl
(4) 装置E的作用是_______________。
【测定NaNO2纯度】
(5) 可供选择的试剂有:
A.稀硫酸 b.c1mol/LKI溶液 C.淀粉溶液 D.c2mol/LNa2S2O3溶液 e.c3 mol/L酸性KMnO4溶液
① 利用NaNO2的还原性来测定其纯度,可选择的试剂是________(填字母)。
② 利用NaNO2的氧化性来测定其纯度的步骤如下:
准确称取质量为m g的NaNO2样品,放入锥形瓶中,加入适量水溶解,_________(请补充完整实验步骤)。
【答案】(l)C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(2)将NO2转化为NO;铜与稀硝酸反应生成NO
(3)B
(4)吸收有毒的NO气体,防止污染空气
(5)①e②加人过量c1mol/LKI溶液、淀粉溶液,然后滴加稀硫酸,用c2mol/LNa2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复以上操 作2~3次
【解析】
试题分析:(1)在装置A三颈烧瓶中浓硝酸与C在加热时发生氧化还原反应,化学方程式为C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O;(2)NO2溶于水,与水发生反应产生NO, 3NO2+ H2O == 2HNO3+ NO,产生的硝酸再与Cu发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O。所以 B装置的作用是将NO2转化为NO,同时铜与稀硝酸反应生成NO;(3) CO2是酸性氧化物,可以与碱性发生反应,可以除去NO中的CO2气体的试剂是碱石灰;(4)NO能被酸性KMnO4氧化成NO3-,E可吸收有毒的NO气体,防止污染空气;(5)① 高锰酸钾溶液具有氧化性,利用NaNO2的还原性来测定其纯度,可选择的试剂是c3 mol/L酸性KMnO4溶液;②在酸性条件下,NaNO2能将I-氧化为I2;S2O32-能将I2还原为I-,利用NaNO2的氧化性来测定其纯度,可选择的试剂是具有还原性的c1mol/LKI溶液、稀硫酸 即作指示剂的淀粉溶液,步骤是:准确称取质量为m g的NaNO2样品,放入锥形瓶中,加入适量水溶解,加人过量c1mol/LKI溶液、淀粉溶液,然后滴加稀硫酸,用c2mol/LNa2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复以上操 作2~3次。
CO2↑+4NO2↑+2H2O;(2)NO2溶于水,与水发生反应产生NO, 3NO2+ H2O == 2HNO3+ NO,产生的硝酸再与Cu发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O。所以 B装置的作用是将NO2转化为NO,同时铜与稀硝酸反应生成NO;(3) CO2是酸性氧化物,可以与碱性发生反应,可以除去NO中的CO2气体的试剂是碱石灰;(4)NO能被酸性KMnO4氧化成NO3-,E可吸收有毒的NO气体,防止污染空气;(5)① 高锰酸钾溶液具有氧化性,利用NaNO2的还原性来测定其纯度,可选择的试剂是c3 mol/L酸性KMnO4溶液;②在酸性条件下,NaNO2能将I-氧化为I2;S2O32-能将I2还原为I-,利用NaNO2的氧化性来测定其纯度,可选择的试剂是具有还原性的c1mol/LKI溶液、稀硫酸 即作指示剂的淀粉溶液,步骤是:准确称取质量为m g的NaNO2样品,放入锥形瓶中,加入适量水溶解,加人过量c1mol/LKI溶液、淀粉溶液,然后滴加稀硫酸,用c2mol/LNa2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复以上操 作2~3次。


科目:高中化学 来源: 题型:
【题目】将Cu放入0.1 molL﹣1FeCl3溶液中,反应一段时间后取出Cu片,溶液中Fe3+与Fe2+的物质的量浓度之比为4:3,则反应后溶液中Cu2+与Fe3+的物质的量之比为
A. 3:2 B. 3:8 C. 4:3 D. 3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能光电池由于具有充电快、寿命长等特点,适于很多特殊环境和场合,现已得到广泛应用。氮化稼(GaN)光电池的结构如图所示。下列说法中正确的是( )

A. 该装置系统中只存在两种能量转化
B. Cu电极上的电极反应为:CO2+8e-+8H+=CH4+2H2O
C. 离子交换膜为质子交换膜,H+从右池移向左池
D. 常温下,当装置中有lmolCH4生成时,GaN电极有44.8LO2生成(不考虑O2的溶解性〕
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其工作原理如图所示。下列说法中不正确的是
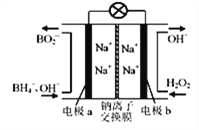
A. 电池放电时Na+从a极区移向b极区
B. 燃料电池是一类能量转化效率高、环境友好的发电装置
C. 该电池的负极反应为BH4-+ 8OH-一8e-═BO2-+ 6H2O
D. 在电池反应中,每消耗3molH2O2,转移电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.都能产生丁达尔效应 B.有相同的颜色
C.分散质颗粒直径都在1-100nm之间 D.加入浓氢氧化钠溶液都产生红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
化学键 | C—H | C—F | H—F | F—F |
键能 | 414 | 489 | 565 | 158 |
CH4(g)+4F2(g)=CF4(g)+4HF(g) ΔH=akJ·mol-1。则a等于
A. -1928 B. +1928 C. +1838 D. -1838
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯化铵溶液中,下列关系式正确的是( )
A. c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B. c(NH4+)> c(Cl-)>c(H+)>c(OH-)
C. c(Cl-)=c(NH4+)>c(H+)=c(OH-)
D. c(NH4+)= c(Cl-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z为0.2 mol·L-1 B.Y2为0.35 mol·L-1
C.X2为0.3 mol·L-1 D.Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月,中国科学家坩呦呦获得了2015年度诺贝尔生理学或医学奖,获奖理由是“因为发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特別是发展中国家的数百万人的生命”。已知青蒿素的一种化学合成方法的部分工艺流程如图24:
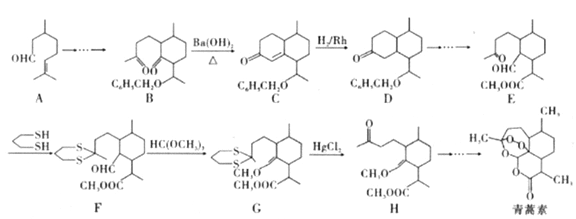
已知:①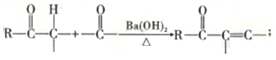
②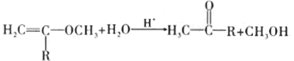
请冋答下列问题:
(1)下列有关说法正确的是_______(填序号)。
A.青蒿素属于环状化合物,但不属于芳香族化合物
B.青蒿素易溶于水,难溶于乙醇、苯等
C.一定条件下,青蒿素能与氢氧化钠溶液反应
D.青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有酯基
(2)化合物A中含有的非含氧官能团的名称是_______,请选择下列合适的试剂来检验该官能团,试剂加入的正确顺序为____。
A.溴水 B.稀盐酸
C.新制氢氧化铜悬浊液 D.氢氧化钠溶液
(3)该工艺流程中设计E→F、G→H的目的是_________________。
(4)H与稀硫酸共热时反应的化学方程式为_____________________。
(5)M与A互为同系物,但比A少两个碳原子。满足下列条件的M的同分异构体有______种(不考虑立体异构)。
①含有六元环 ②能发生银镜反应
(6)请结合所学知识和上述信息,写出以笨甲醛和氯乙烷为原料,制备苄基乙醛(![]() CH2CH2CHO)的路线流程图。_______________________(无机试剂任选,合成路线流程图示例如下:
CH2CH2CHO)的路线流程图。_______________________(无机试剂任选,合成路线流程图示例如下:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com