
【题目】2015年10月,中国科学家坩呦呦获得了2015年度诺贝尔生理学或医学奖,获奖理由是“因为发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特別是发展中国家的数百万人的生命”。已知青蒿素的一种化学合成方法的部分工艺流程如图24:
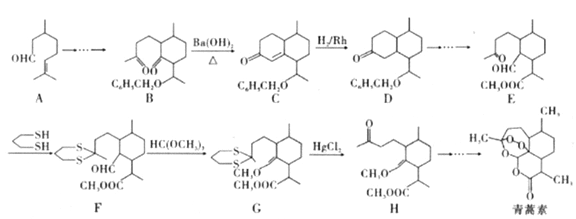
已知:①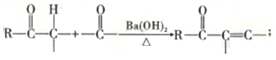
②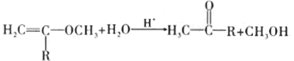
请冋答下列问题:
(1)下列有关说法正确的是_______(填序号)。
A.青蒿素属于环状化合物,但不属于芳香族化合物
B.青蒿素易溶于水,难溶于乙醇、苯等
C.一定条件下,青蒿素能与氢氧化钠溶液反应
D.青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有酯基
(2)化合物A中含有的非含氧官能团的名称是_______,请选择下列合适的试剂来检验该官能团,试剂加入的正确顺序为____。
A.溴水 B.稀盐酸
C.新制氢氧化铜悬浊液 D.氢氧化钠溶液
(3)该工艺流程中设计E→F、G→H的目的是_________________。
(4)H与稀硫酸共热时反应的化学方程式为_____________________。
(5)M与A互为同系物,但比A少两个碳原子。满足下列条件的M的同分异构体有______种(不考虑立体异构)。
①含有六元环 ②能发生银镜反应
(6)请结合所学知识和上述信息,写出以笨甲醛和氯乙烷为原料,制备苄基乙醛(![]() CH2CH2CHO)的路线流程图。_______________________(无机试剂任选,合成路线流程图示例如下:
CH2CH2CHO)的路线流程图。_______________________(无机试剂任选,合成路线流程图示例如下:![]() )
)
【答案】 AC 碳碳双键 CBA 保护羰基  5
5 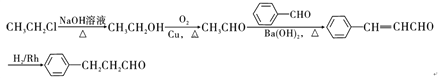
【解析】本题考查有机物的推断和合成,(1)A、青蒿素中含有环,属于环状化合物,但没有苯环,不属于芳香化合物,故A正确;B、青蒿素属于有机物,易溶于乙醇和苯,故B错误;C、青蒿素中含有酯基,与氢氧化钠发生水解反应,故C正确;D、根据青蒿素的结构简式,含有过氧键,能把I-氧化成I2,淀粉遇碘单质变蓝,故D错误;(2)根据A的结构简式,含有官能团是醛基和碳碳双键,其中不含氧的官能团是碳碳双键;因为醛基能被溴水氧化,先加新制氢氧化铜悬浊液,把醛基氧化成-COONH4,因为溶液显碱性,因此需要加酸中和,最后加入溴水,因此加入试剂的顺序是CBA;(3)对比E和F的结构简式,羰基的C=O变成C-S单键,G和H的结构简式对比,C-S单键变成羰基,因此目的是保护羰基;(4)根据信息②,推出H与稀硫酸发生反应的方程式为 ;(5)A的结构为
;(5)A的结构为![]() ,M与A互为同系物,但比A少两个碳原子,含有碳碳双键和醛基,则M的化学式为C8H14O,因此满足条件的M的同分异构体为:
,M与A互为同系物,但比A少两个碳原子,含有碳碳双键和醛基,则M的化学式为C8H14O,因此满足条件的M的同分异构体为:![]() 、
、![]() (邻、间、对位3种)、
(邻、间、对位3种)、![]() ,共5种;(6)结合流程中B→C→D的变化分析设计,氯乙烷在氢氧化钠水溶液、加热条件下生成乙醇,乙醇催化氧化生成乙醛,乙醛与苯甲醛在氢氧化钡条件下生成
,共5种;(6)结合流程中B→C→D的变化分析设计,氯乙烷在氢氧化钠水溶液、加热条件下生成乙醇,乙醇催化氧化生成乙醛,乙醛与苯甲醛在氢氧化钡条件下生成![]() ,在氢气/Rh条件下发生加成反应生成
,在氢气/Rh条件下发生加成反应生成![]() ,工艺流程图如下:
,工艺流程图如下: 。
。


科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用如图所示装罝制备NaNO2并对其性质作如下探究(A中加热装罝已略去)。

已知:
① 2NO+Na2O2=2NaNO2。
② NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。
③ 在酸性条件下,NaNO2能将I-氧化为I2;S2O32-能将I2还原为I-。
④ 在此条件下,Na2O2完全反应,无剩余。
【制备NaNO2】
(1) 装置A的三颈烧瓶中发生反应的化学方程式为_____________。
(2) 装置B中水和铜的作用分别是__________、__________。
(3) 为了保证制得亚硝酸钠的纯度,装置C中盛放的试剂可能是_________(填字母)。
A.P2O5 B.碱石灰 C.无水CaCl2 D.NaCl
(4) 装置E的作用是_______________。
【测定NaNO2纯度】
(5) 可供选择的试剂有:
A.稀硫酸 b.c1mol/LKI溶液 C.淀粉溶液 D.c2mol/LNa2S2O3溶液 e.c3 mol/L酸性KMnO4溶液
① 利用NaNO2的还原性来测定其纯度,可选择的试剂是________(填字母)。
② 利用NaNO2的氧化性来测定其纯度的步骤如下:
准确称取质量为m g的NaNO2样品,放入锥形瓶中,加入适量水溶解,_________(请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存且溶液颜色为无色的是
A. Na+、MnO4-、K+、NO3-、SO32- B. Na+、S2-、SO32-、H+、、NO3-
C. Na+、S2-、OH-、K+、Cl- D. HCO3-、H+、Na+、Ca2+、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用电化学理论解释的是 ( )
A. 轮船水线以下的船壳上装一定数量的锌块
B. 铝片不用特殊方法保存
C. 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快
D. 镀锌的铁比镀锡的铁耐用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
A. KSCN B. BaCl2 C. NaOH D. HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】L、M、R、T、W是原子序数依次增大的短周期主族元素,M、T在周期表中的相对位置如下表,L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料。
M | |
T |
请回答下列问题:
(1)T离子的结构示意图为__________,元素W在周期表中位于第______族,M单质分子的电子式为__________。
(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶盛放氢氧化钠溶液的原因是(用化学方程式表示)__________。
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)__________。
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下,L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可用于工业炼铁。制备RW4的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验Ⅰ~Ⅳ的说法正确的是
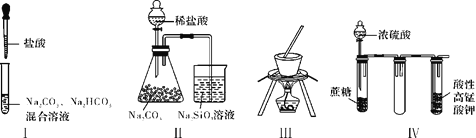
A. 实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡
B. 实验Ⅱ:通过实验现象可比较氯、碳、硅三种元素的非金属性强弱
C. 实验Ⅲ:本装置可以用于从饱和食盐水制取NaCl晶体
D. 实验Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1 = -870.3KJ/mol
(2)C(s)+O2(g)=CO2(g) △H2 = -393.5KJ/mol
(3)H2(g)+![]() O2(g)=H2O(l) △H3 = -285.8KJ/mol
O2(g)=H2O(l) △H3 = -285.8KJ/mol
试计算下列反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l) H =
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com