
【题目】下列事实不能用电化学理论解释的是 ( )
A. 轮船水线以下的船壳上装一定数量的锌块
B. 铝片不用特殊方法保存
C. 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快
D. 镀锌的铁比镀锡的铁耐用
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其工作原理如图所示。下列说法中不正确的是
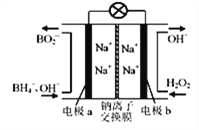
A. 电池放电时Na+从a极区移向b极区
B. 燃料电池是一类能量转化效率高、环境友好的发电装置
C. 该电池的负极反应为BH4-+ 8OH-一8e-═BO2-+ 6H2O
D. 在电池反应中,每消耗3molH2O2,转移电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z为0.2 mol·L-1 B.Y2为0.35 mol·L-1
C.X2为0.3 mol·L-1 D.Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温条件下将Cl2缓缓通入NH3中,反应生成NH4Cl和N2.下列说法正确的是
A. 反应过程中无明显现象 B. 反应为放热反应
C. 每有3molCl2反应,被氧化NH3为8mol D. NH4Cl是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学和各类平衡等都是化学研究的对象
(1)已知:①2O2(g)+N2(g)==N2O4(l) △H1;
②N2(g)+2H2(g)==N2H4(g) △H2;
③O2(g)+2H2(g)==2H2O(g) △H3;
④2N2H4(g) +N2O4(1)==3N2(g)+4H2O(g) △H4。
上述反成热效应之间的关系式为△H4 =_______(用含△H1、△H2、△H3的代数式表示)。
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) ![]() H2(g)+CO2(g),得到如下表三组数据:
H2(g)+CO2(g),得到如下表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 800 | 2 | 4 | 4/3 | 8/3 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①该反应的逆反应为______(填“吸热”或“放热”)反应;实验2的平衡常数K=________。
②若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是_______(用含a、b的代数式表示)。
③若保持温度和容积不变,向实验1再增加4molH2O(g),使反应达到新的平衡。下列说法不正确的是______(填序号)。
A.新、旧平衡时容器内气体的压强之比是5 : 3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-l
D.新、旧平衡时容器内气体密度之比为5 : 3
(3)室温下,用0.1 mol·L-l的KOH溶液滴定10.00Ml0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
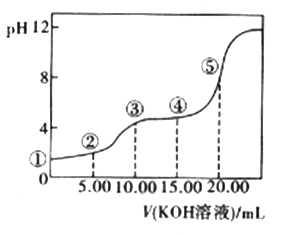
a.点②所示溶液中的电荷守恒式为________________________。
b.点③所示溶液中所有离子的浓度由大到小的顺序为___________________。
c.成④所示溶液中c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp (CaC2O4)=4.010-9,若在c(Ca2+)=0.020mol·L-1的溶液生成CaC2O4沉淀,溶液中的c(C2O42-)最小应为( )
A. 4.010-9mol·L-1 B. 2.010-7mol·L-1 C. 2.010-9mol·L-1 D. 8.010-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月,中国科学家坩呦呦获得了2015年度诺贝尔生理学或医学奖,获奖理由是“因为发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特別是发展中国家的数百万人的生命”。已知青蒿素的一种化学合成方法的部分工艺流程如图24:
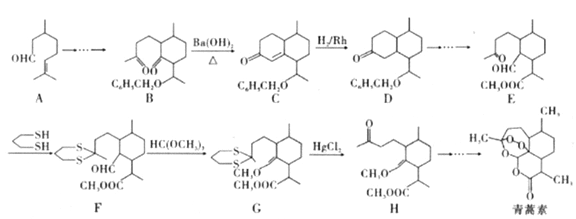
已知:①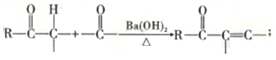
②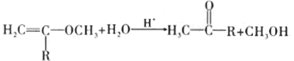
请冋答下列问题:
(1)下列有关说法正确的是_______(填序号)。
A.青蒿素属于环状化合物,但不属于芳香族化合物
B.青蒿素易溶于水,难溶于乙醇、苯等
C.一定条件下,青蒿素能与氢氧化钠溶液反应
D.青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有酯基
(2)化合物A中含有的非含氧官能团的名称是_______,请选择下列合适的试剂来检验该官能团,试剂加入的正确顺序为____。
A.溴水 B.稀盐酸
C.新制氢氧化铜悬浊液 D.氢氧化钠溶液
(3)该工艺流程中设计E→F、G→H的目的是_________________。
(4)H与稀硫酸共热时反应的化学方程式为_____________________。
(5)M与A互为同系物,但比A少两个碳原子。满足下列条件的M的同分异构体有______种(不考虑立体异构)。
①含有六元环 ②能发生银镜反应
(6)请结合所学知识和上述信息,写出以笨甲醛和氯乙烷为原料,制备苄基乙醛(![]() CH2CH2CHO)的路线流程图。_______________________(无机试剂任选,合成路线流程图示例如下:
CH2CH2CHO)的路线流程图。_______________________(无机试剂任选,合成路线流程图示例如下:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于溶解平衡的说法中,错误的是( )
A.溶解平衡的本质是结晶速率等于溶解速率
B.在不饱和溶液中,溶质的溶解速率小于结晶速率
C.在饱和溶液中,晶体的质量不改变,形状可能改变
D.当物质达到溶解平衡时,不改变外界条件,溶液的浓度也不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com