
【题目】热化学和各类平衡等都是化学研究的对象
(1)已知:①2O2(g)+N2(g)==N2O4(l) △H1;
②N2(g)+2H2(g)==N2H4(g) △H2;
③O2(g)+2H2(g)==2H2O(g) △H3;
④2N2H4(g) +N2O4(1)==3N2(g)+4H2O(g) △H4。
上述反成热效应之间的关系式为△H4 =_______(用含△H1、△H2、△H3的代数式表示)。
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) ![]() H2(g)+CO2(g),得到如下表三组数据:
H2(g)+CO2(g),得到如下表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 800 | 2 | 4 | 4/3 | 8/3 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①该反应的逆反应为______(填“吸热”或“放热”)反应;实验2的平衡常数K=________。
②若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是_______(用含a、b的代数式表示)。
③若保持温度和容积不变,向实验1再增加4molH2O(g),使反应达到新的平衡。下列说法不正确的是______(填序号)。
A.新、旧平衡时容器内气体的压强之比是5 : 3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-l
D.新、旧平衡时容器内气体密度之比为5 : 3
(3)室温下,用0.1 mol·L-l的KOH溶液滴定10.00Ml0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
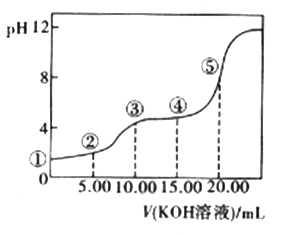
a.点②所示溶液中的电荷守恒式为________________________。
b.点③所示溶液中所有离子的浓度由大到小的顺序为___________________。
c.成④所示溶液中c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=________mol/L。
【答案】 2△H3-2△H2-△H1 吸热 0.17(或![]() ) b=2a且a>1 BD c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-) c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) 0.10
) b=2a且a>1 BD c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-) c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) 0.10
【解析】(1)本题考查热化学反应方程式的计算,根据盖斯定律,应是2×③-②×2-①得出△H4=2△H3-2△H2-△H1;(2)①考查化学平衡常数计算,
实验1组 H2O(g)+CO(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度: 1 2 0 0
变化浓度:2/3 2/3 2/3 2/3
平衡浓度:1/3 4/3 2/3 2/3 根据平衡常数的表达式K=c(CO2)×c(H2)/[c(CO)×c(H2O)]=2×2/(1×4)=1,同理实验2的化学平衡常数为1/6,升高温度平衡向逆反应方向移动,即逆反应方向是吸热反应;②考查等效平衡,两组实验达到平衡,组分的体积分数相等,说明两个平衡是等效平衡,即a/b=2/4,b=2a,实验3达到平衡所用时间比实验2少,说明实验3反应速率快,反应物物质的量比实验2大,即a>1,综上所述,,b=2a,且a>1;③再通入4mol水蒸气时,设生成二氧化碳x mol·L-1,则 H2O(g)+CO(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
初始浓度: 3 2 0 0
变化浓度: x x x x
平衡浓度: 3-x 2-x x x 温度不变,化学平衡常数不变,则有K=x2/[(3-x)×(2-x)]=1,解得x=1.2,A、压强之比等于物质的量之比,旧平衡物质的量为(1/3+4/3+2/3+2/3)×2mol=6mol,新平衡物质的量为(1.8+0.8+1.2+1.2)×2mol=10,新平衡与旧平衡的压强之比为10:6=5:3,故A说法正确;B、旧平衡H2O的转化率为2/3,新平衡H2O的转化率为0.4,因此新平衡H2O的转化率降低,故B说法错误;C新平衡是CO的浓度为0.8mol·L-1,故C说法正确;D、两个平衡容器的容积相同,即密度之比等于气体质量之比,旧平衡的密度与新平衡的密度之比为(1×18+2×28)×2:(3×18+2×28)×2=74:110 ≠3:5,故D说法错误;(3)a.因为草酸是二元弱酸,当加入10mLKOH时,溶液中的溶质为KHC2O4,因此点②时,溶液中的溶质为NaHC2O4和H2C2O4,电荷守恒:c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-);b.根据a的分析,此时溶液中溶质为KHC2O4,③时溶液显酸性,说明HC2O4-的电离程度大于其水解程度,即离子浓度大小关系是c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) ;c.当加入20mLKOH时,溶液中的溶质为K2C2O4,因此④点时的溶质为KHC2O4和K2C2O4,根据物料守恒:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=10×10-3×0.1/25×10-3mol·L-1=0.04mol·L-1,c(K+)=15×10-3×0.1/25×10-3mol·L-1=0.06mol·L-1, c( K+) +c( H2C2O4) +c( HC2O4-)+c(C2O42-)=0.1mol·L-1。


科目:高中化学 来源: 题型:
【题目】Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙错误的是
A. 负极反应式为Mg-2e-=Mg2+
B. 正极反应式为Ag+e-=Ag
C. 电池放电时Cl-由正极向负极迁移
D. 电池放电时,外电路中,电子由负极向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存且溶液颜色为无色的是
A. Na+、MnO4-、K+、NO3-、SO32- B. Na+、S2-、SO32-、H+、、NO3-
C. Na+、S2-、OH-、K+、Cl- D. HCO3-、H+、Na+、Ca2+、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质与其用途的关系不正确的是( )
A.过氧化钠:供氧剂 B.碱石灰:干燥剂
C.小苏打:发酵粉主要成分 D.纯碱:治疗胃酸过多的一种药剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用电化学理论解释的是 ( )
A. 轮船水线以下的船壳上装一定数量的锌块
B. 铝片不用特殊方法保存
C. 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快
D. 镀锌的铁比镀锡的铁耐用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】L、M、R、T、W是原子序数依次增大的短周期主族元素,M、T在周期表中的相对位置如下表,L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料。
M | |
T |
请回答下列问题:
(1)T离子的结构示意图为__________,元素W在周期表中位于第______族,M单质分子的电子式为__________。
(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶盛放氢氧化钠溶液的原因是(用化学方程式表示)__________。
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)__________。
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下,L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可用于工业炼铁。制备RW4的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g) △H <0,下列说法正确的是( )
2AB2(g) △H <0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com