
【题目】已知铷(![]() )是37号元素,其相对原子质量是85.5,与钠位于同一主族,回答下列问题:
)是37号元素,其相对原子质量是85.5,与钠位于同一主族,回答下列问题:
(1)铷位于第______周期,其原子半径比钠元素的原子半径______(填“大”或“小”)。
(2)铷单质性质活泼,写出在点燃条件下它与氯气反应的化学方程式:________________________;铷单质易与水反应,反应的离子方程式为________________________,实验表明铷与水反应比钠与水反应______(填“剧烈”或“缓慢”);反应过程中铷在水______(填“面”或“底”)与水反应,原因是__________________。
(3)同主族元素的同类化合物的化学性质相似,写出过氧化铷与![]() 反应的化学方程式:________________。
反应的化学方程式:________________。
【答案】5 大 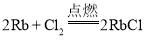
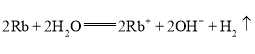 剧烈 底 铷的密度比水的密度大
剧烈 底 铷的密度比水的密度大 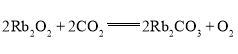
【解析】
铷是37号元素,原子结构中有5个电子层, Rb为碱金属元素,根据Na的性质结合同主族金属元素的性质递变规律来分析。
(1)铷是37号元素,原子结构中有5个电子层,最外层电子数为1,则位于第五周期,原子半径比钠原子大,故答案为:5;大;
(2)铷单质性质与钠的性质相似,但比钠更活泼,与氯气反应生产氯化铷,化学方程式为: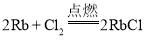 ;与水反应生成氢氧化铷:
;与水反应生成氢氧化铷: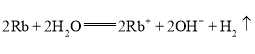 ,比与水反应更剧烈,由于铷的密度比水大,反应时铷沉在水底;故答案为:
,比与水反应更剧烈,由于铷的密度比水大,反应时铷沉在水底;故答案为: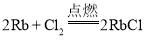 ;
;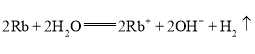 ;剧烈;底;铷的密度比水的密度大;
;剧烈;底;铷的密度比水的密度大;
(3)过氧化钠与二氧化碳反应生成碳酸钠和氧气,同主族元素的同类化合物的化学性质相似,过氧化铷与二氧化碳生成碳酸铷和氧气: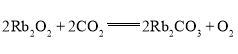 ;故答案为:
;故答案为: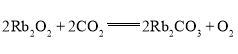 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】分析核电荷数为1 ~ 18的元素原子的核外电子层数和最外层电子数,回答下列问题:
(1)核电荷数为6和14的元素原子,它们的____________相同,____________不相同;核电荷数为15和16的元素原子,它们的____________相同,____________不相同;核电荷数为10和18的元素原子,它们的最外层电子数均为____________,它们的元素符号分别是____________、____________。
(2)某元素的原子核外有三个电子层,最外层电子数是核外电子总数的![]() ,该元素的元素符号是____________,原子结构示意图是____________。
,该元素的元素符号是____________,原子结构示意图是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种主族元素,已知:(a)A原子有四个电子层,其K、L层电子数分别与N、M层电子数相等;(b)B、C原子核外电子层数比A原子少1,B的最高正价和最低负价的代数和等于零,C的简单气态氢化物的化学式是H2C;(c)D、E的阴离子都带有一个单位的负电荷,D的阴离子的电子层结构与氩原子相同,E元素没有对应的含氧酸;(d)F与A位于同一周期且是六种元素中原子半径最大的元素。
(1)写出六种元素的名称:A___;B___;C___;D___;E___;F___。
(2)A、C、D、F四种元素的简单离子的半径由大到小的顺序为____(用离子符号表示)。
(3)B、C、D三种元素的简单气态氢化物的稳定性由强到弱的顺序为___(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钍![]() Th的原子可发生下列放射性变化:
Th的原子可发生下列放射性变化: ![]() Th→
Th→![]() X+
X+![]() He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
A. X的氢氧化物是一种强碱B. X元素位于第六周期
C. X的碳酸盐难溶于水D. X的最高化合价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中元素________(填写元素符号)的非金属性最强;元素________(填写元素符号)的金属性最强,写出它与水反应的离子方程式__________________________________。
(2)表中元素③的原子结构示意图是________。
(3)表中元素⑥、⑦氢化物的稳定性顺序为________>________(填写化学式,下同)。
(4)表中元素最高价氧化物对应水化物酸性最强的酸的分子式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性能,被广泛应用于电子工业、陶瓷工业 等领域,其结构类似于金刚石。一定条件下,氮化铝可通过反应 Al2O3+N2+3C=2AlN+3CO 合成, 下述正确的是
A.氮化铝晶体属于分子晶体
B.由于 AlN 相对分子质量比立方 BN 大,所以熔沸点 AlN 比 BN 高
C.AlN 中原子 Al 杂化方式为 sp2,N 杂化方式为 sp3
D.氮化铝晶体中含有配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计以下实验。
Ⅰ.(1)将钠、钾、镁、铝各1![]() 分别投入足量的0.1
分别投入足量的0.1![]() 的盐酸中,试预测实验结果:______与盐酸反应最剧烈,______与盐酸反应最慢。
的盐酸中,试预测实验结果:______与盐酸反应最剧烈,______与盐酸反应最慢。
(2)将![]() 溶液与
溶液与![]() 溶液混合生成
溶液混合生成![]() ,从而验证
,从而验证![]() 的碱性强于
的碱性强于![]() ,继而可以验证
,继而可以验证![]() 的金属性强于
的金属性强于![]() 。此设计______(填“合理”或“不合理”),理由是________________________。
。此设计______(填“合理”或“不合理”),理由是________________________。
Ⅱ.利用如图所示装置可以验证非金属性的变化规律。
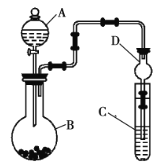
(3)仪器![]() 的名称为____________,干燥管
的名称为____________,干燥管![]() 的作用是__________________。
的作用是__________________。
(4)实验室中现有药品:![]() 溶液、
溶液、![]() 浓盐酸、
浓盐酸、![]() ,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置
,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置![]() 、
、![]() 、
、![]() 中所装药品分别为____________、____________、____________,装置
中所装药品分别为____________、____________、____________,装置![]() 中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______________________________________。
中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______________________________________。
(5)若要证明非金属性:![]() ,则
,则![]() 中加__________,
中加__________,![]() 中加
中加![]() ,
,![]() 中加__________,观察到
中加__________,观察到![]() 中的现象为______________________________。
中的现象为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
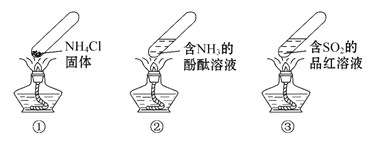
A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.FeCl3溶液腐蚀铜线路板:Fe3++Cu=Fe2++Cu2+
B.氯气通入水中:Cl2+H2O=2H++ClO-+Cl-
C.金属铝加入到NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
D.Na2O加入稀硫酸中:O2-+2H+=H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com