
【题目】下列离子组加入相应试剂后,发生反应的离子方程式正确的是( )
离子组 | 加入试剂 | 离子方程式 | |
A | Na+、 | Ba(OH)2溶液 | 2Na++ |
B | H+、Cl- | 足量石灰乳 | 2H++2OH-=2H2O |
C | K+、 | NaHSO4溶液 |
|
D | Ag+、 | 少量盐酸 | Ag++ |
A.AB.BC.CD.D
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】某小组报用含稀硫酸的KMnO4,溶液与H2C2O4溶液(弱酸)的反应(此反应为放热反应)来探究"条件对化学反应速率的影响",并设计了如表的方案记录实验结果(忽略溶液混合体积变化),限选试剂和仪器:0.2mol L-1H2C2O4溶液、0.010mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
项目 | V(0.2mol L-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010mol·L-1KMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.0 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题
(1完成上述反应原理的化学反应方程式____________________________________
(2)上述实验①②是探究___________对化学反应速率的影响;若上述实验②③是探究浓度的对化学反应速率的影响,则a为______;乙是实验需要测量的物理量,则表格中“乙”应填写_______;上述实验②④是探究__________对化学反应速率的影响
(3)已知草酸为二元弱酸,其电离方程式为___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为室温下某二元酸H2M溶液中H2M、HM-、M2-的浓度对数lgc随pH的变化图象。下列分析错误的是

A.该二元酸溶液浓度为0.010 mol/L
B.pH=1.89时,c(H2M)=c(HM-)>c(M2-)
C.pH=7.0时,lgc(M2-)-lgc(HM-)=0.77
D.在NaHM溶液中,水的电离受到抑制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3溶液常用于蚀刻电路板,蚀刻后的酸性溶液中含有Cu2+、Fe2+、Fe3+、Cl-等。下列各组离子能在该酸性溶液中大量共存的是( )
A.Na+、Al3+、Cl-、SO42-B.Ca2+、Mg2+、NO3-、ClO-
C.K+、NH![]() 、SO32-、AlO2-D.Ba2+、K+、I-、NO3-
、SO32-、AlO2-D.Ba2+、K+、I-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
B.2 molCO的摩尔质量和1 mol CO的摩尔质量
C.64 g二氧化硫中氧原子数和标准状况下22.4 LCO中氧原子数
D.20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,它的制取与应用一直是人类研究的热点。
(1)用甲醇和水蒸气在催化剂、加热条件下制氢的相关热化学方程式如下:
CH3OH(g)=CO(g)+2H2(g);ΔH=+90.7 kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g);ΔH=-41.2 kJ/mol
①反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)能自发进行的原因是________。
CO2(g)+3H2(g)能自发进行的原因是________。
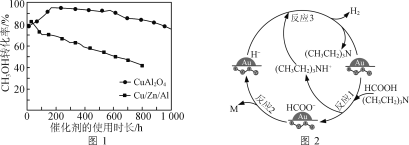
②将一定比例的CH3OH(g)和H2O(g)的混合气体,以相同速率通过装有不同催化剂的反应器。CH3OH转化率随催化剂的使用时长变化如图1所示,催化剂CuAl2O4与催化剂Cu/Zn/Al相比,优点有____________________。
③向Cu(NO3)2、Al(NO3)3混合溶液中滴加NaOH溶液可获得沉淀物[Cu(OH)2、Al(OH)3],以便于制取CuAl2O4。为确保Cu2+、Al3+完全沉淀(浓度≤10-5 mol/L),应控制混合液pH的最小整数值为________{Ksp[Cu(OH)2]=2.2×10-20,Ksp[Al(OH)3]=1.3×10-33}。
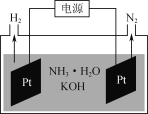
(2)用Au/ZrO2作催化剂,在(CH3CH2)3N作用下HCOOH分解制氢的原理如图2所示。反应2中生成物M的化学式为__________________,图示反应中只有氢元素化合价发生变化的是反应________(填“1”“2”或“3”)。
(3)如图是电解氨水和KOH混合溶液制氢的装置示意图。生成N2的电极反应式为______________。
(4)富氧条件下,H2还原NOx包括两个阶段:第一阶段为H2、NOx在催化剂作用下转变为H2O、N2、NH3;第二阶段NH3在载体酸的作用下生成NH4+,NH4+将NOx还原为N2。写出NO与O2的物质的量之比为1∶1时,NH4+与NO、O2反应生成N2的离子反应方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种药物中间体,可以通过以下方法合成:
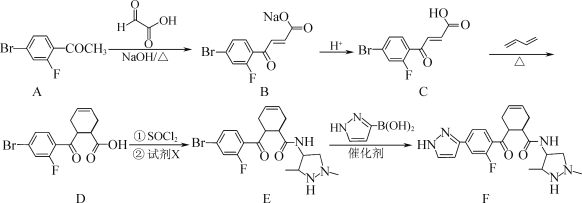
(1)C中的含氧官能团名称为________和________。
(2)E![]() F的反应类型为________。
F的反应类型为________。
(3)试剂X的分子式为C5H13N3,写出X的结构简式:________。
(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;② 分子中只有4种不同化学环境的氢。
(5)写出以CH3CH=CHCH3、HCHO及CH3COCH3为原料制备![]() 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种。现做如下实验:
(1)取少量该溶液,滴入用硝酸酸化的AgNO3溶液,有白色沉淀生成。
(2)另取部分溶液,加入氢氧化钠,有白色沉淀产生,加入氢氧化钠的量与生成白色沉淀的量可用右图表示。
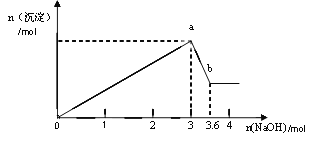
试推断:
(1)该溶液中以上离子一定存在的有___________,一定不存在的有____________。
(2)上述溶液中至少有_____________、(填化学式)等物质混合而成,其物质的量的比为_________。
(3)写出图中a![]() b变化过程的离子方程式_________________。
b变化过程的离子方程式_________________。
(4)为进一步确定溶液中其他的阳离子,应该补充的实验是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某元素的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,各物质转化关系如图所示。下列说法正确的是

A. A是可与草木灰混合使用的肥料 B. C可用排空气法收集
C. F和B能发生复分解反应生成盐 D. B在一定条件下可直接与Y反应生成D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com