
ΓΨΧβΡΩΓΩ«βΤχ «“Μ÷÷«εΫύΡή‘¥Θ§ΥϋΒΡ÷Τ»Γ”κ”Π”Ο“Μ÷± «»Υάύ―–ΨΩΒΡ»»ΒψΓΘ
(1)”ΟΦΉ¥ΦΚΆΥ°’τΤχ‘Ύ¥ΏΜ·ΦΝΓΔΦ”»»ΧθΦΰœ¬÷Τ«βΒΡœύΙΊ»»Μ·―ßΖΫ≥Χ Ϋ»γœ¬ΘΚ
CH3OH(g)=CO(g)+2H2(g)ΘΜΠΛH=+90.7 kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g)ΘΜΠΛH=-41.2 kJ/mol
ΔΌΖ¥”ΠCH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)ΡήΉ‘ΖΔΫχ––ΒΡ‘≠“ρ «________ΓΘ
CO2(g)+3H2(g)ΡήΉ‘ΖΔΫχ––ΒΡ‘≠“ρ «________ΓΘ
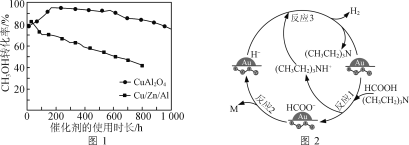
ΔΎΫΪ“ΜΕ®±»άΐΒΡCH3OH(g)ΚΆH2O(g)ΒΡΜλΚœΤχΧεΘ§“‘œύΆ§ΥΌ¬ Ά®ΙΐΉΑ”–≤ΜΆ§¥ΏΜ·ΦΝΒΡΖ¥”ΠΤςΓΘCH3OHΉΣΜ·¬ Υφ¥ΏΜ·ΦΝΒΡ Ι”Ο ±≥Λ±δΜ·»γΆΦ1Υυ ΨΘ§¥ΏΜ·ΦΝCuAl2O4”κ¥ΏΜ·ΦΝCu/Zn/Alœύ±»Θ§”≈Βψ”–____________________ΓΘ
ΔέœρCu(NO3)2ΓΔAl(NO3)3ΜλΚœ»ή“Κ÷–ΒΈΦ”NaOH»ή“ΚΩ…ΜώΒΟ≥ΝΒμΈο[Cu(OH)2ΓΔAl(OH)3]Θ§“‘±ψ”Ύ÷Τ»ΓCuAl2O4ΓΘΈΣ»Ζ±ΘCu2+ΓΔAl3+Άξ»Ϊ≥ΝΒμΘ®≈®Ε»Γή10-5 mol/LΘ©Θ§”ΠΩΊ÷ΤΜλΚœ“ΚpHΒΡΉν–Γ’ϊ ΐ÷ΒΈΣ________{Ksp[Cu(OH)2]=2.2ΓΝ10-20Θ§Ksp[Al(OH)3]=1.3ΓΝ10-33}ΓΘ
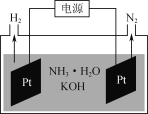
(2)”ΟAu/ZrO2Ής¥ΏΜ·ΦΝΘ§‘Ύ(CH3CH2)3NΉς”Οœ¬HCOOHΖ÷Ϋβ÷Τ«βΒΡ‘≠άμ»γΆΦ2Υυ ΨΓΘΖ¥”Π2÷–…ζ≥…ΈοMΒΡΜ·―ß ΫΈΣ__________________Θ§ΆΦ ΨΖ¥”Π÷–÷Μ”–«β‘ΣΥΊΜ·ΚœΦέΖΔ…ζ±δΜ·ΒΡ «Ζ¥”Π________Θ®ΧνΓΑ1Γ±ΓΑ2Γ±ΜρΓΑ3Γ±Θ©ΓΘ
(3)»γΆΦ «ΒγΫβΑ±Υ°ΚΆKOHΜλΚœ»ή“Κ÷Τ«βΒΡΉΑ÷Ο Ψ“βΆΦΓΘ…ζ≥…N2ΒΡΒγΦΪΖ¥”Π ΫΈΣ______________ΓΘ
(4)ΗΜ―θΧθΦΰœ¬Θ§H2ΜΙ‘≠NOxΑϋά®ΝΫΗωΫΉΕΈΘΚΒΎ“ΜΫΉΕΈΈΣH2ΓΔNOx‘Ύ¥ΏΜ·ΦΝΉς”Οœ¬ΉΣ±δΈΣH2OΓΔN2ΓΔNH3ΘΜΒΎΕΰΫΉΕΈNH3‘Ύ‘ΊΧεΥαΒΡΉς”Οœ¬…ζ≥…NH4+Θ§NH4+ΫΪNOxΜΙ‘≠ΈΣN2ΓΘ–¥≥ωNO”κO2ΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ1ΓΟ1 ±Θ§NH4+”κNOΓΔO2Ζ¥”Π…ζ≥…N2ΒΡάκΉ”Ζ¥”ΠΖΫ≥Χ ΫΘΚ__________________________ΓΘ
ΓΨ¥πΑΗΓΩΆ®ΙΐΦΤΥψΩ…÷ΣΗΟΖ¥”ΠΠΛH=+49.5 kJ/molΘ§‘ρΗΟΖ¥”ΠΡήΙΜΉ‘ΖΔΫχ––ΒΡ‘≠“ρ «ΠΛS>0 CuAl2O4¥ΏΜ·ΦΝΜν–‘ΗϋΗΏΘ§«“ Ι”ΟΫœ≥Λ ±ΦδΚσΘ§ΜΙΡή±Θ≥÷ΫœΗΏΒΡΜν–‘ 7 CO2 3 2NH3ΓΛH2O+6OH--6e-=N2Γϋ+8H2O 4NH4++2NO+2O2=3N2+6H2O+4H+
ΓΨΫβΈωΓΩ
(1)ΔΌΗυΨί“―÷Σ»»Μ·―ßΖΫ≥Χ ΫΘ§ΫαΚœΗ«ΥΙΕ®¬…ΒΟΒΫΗΟΖ¥”ΠΒΡΖ¥”Π»»Θ§»ΜΚσάϊ”ΟΖ¥”ΠΉ‘ΖΔΫχ––ΒΡ≈–Εœ“άΨίΖ÷ΈωΘΜ
ΔΎΗυΨί¥ΏΜ·ΦΝΒΡ¥ΏΜ·Μν–‘ΗΏΒΆΦΑ±Θ≥÷ΗΏ–ß–‘ΒΡ ±Φδ≥ΛΕΧΖ÷ΈωΘΜ
ΔέΗυΨί≥ΝΒμΒΡ»ήΕ»Μΐ≥Θ ΐΦΤΥψΖ÷±π–Έ≥…≥ΝΒμ ±»ή“ΚΒΡpHΘ§‘Ό»ΖΕ®–Έ≥…ΝΫ÷÷≥ΝΒμΒΡΉν–ΓpHΘΜ
(2)ΗυΨίΖ¥”Π«ΑΚσ‘ΣΥΊ ΊΚψΦΑΈΔΝΘ¥χ”–ΒΡΒγΚ… ΐΡΩΘ§»ΖΕ®MΜ·―ß ΫΘΜάϊ”ΟΆΦ Ψ÷–Ζ¥”Π«ΑΚσΈο÷ ΈΔΝΘ‘Ύ‘ΣΥΊΜ·ΚœΦέΖ÷Έω≈–Εœ÷Μ”–H‘ΣΥΊΜ·ΚœΦέΖΔ…ζ±δΜ·ΒΡΖ¥”ΠΘΜ
(3)‘ΎΗΟΒγΫβΉΑ÷Ο÷–Θ§H+‘Ύ“θΦΪΒΟΒΫΒγΉ”Θ§≤ζ…ζH2Θ§NH3ΓΛH2O÷–-3ΦέΒΡN ß»ΞΒγΉ”Θ§ΖΔ…ζ―θΜ·Ζ¥”Π≤ζ…ζN2ΘΜ
(4)NH4+ΫΪNOxΜΙ‘≠ΈΣN2Θ§”…”ΎNO”κO2ΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ1ΓΟ1Θ§ΫαΚœΒγΉ” ΊΚψΓΔ‘≠Ή” ΊΚψΚΆΒγΚ… ΊΚψ ι–¥Ζ¥”ΠΖΫ≥Χ ΫΓΘ
(1)ΔΌ(i)CH3OH(g)=CO(g)+2H2(g)ΘΜΠΛH=+90.7 kJ/mol
(ii)CO(g)+H2O(g)=CO2(g)+H2(g)ΘΜΠΛH=-41.2 kJ/mol
ΗυΨίΗ«ΥΙΕ®¬…Θ§ΫΪ(i)+(ii)Θ§’ϊάμΩ…ΒΟCH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) Θ§ΠΛH=+49.5 kJ/mol>0Θ§ΗΟΖ¥”ΠΒΡ’ΐΖ¥”Π «ΤχΧεΧεΜΐ‘ω¥σΒΡΖ¥”ΠΘ§ΗυΨίΖ¥”ΠΉ‘ΖΔΫχ––ΒΡ≈–Εœ“άΨίΠΛG=ΠΛH-TΠΛS<0Θ§»τΖ¥”ΠΡήΙΜΉ‘ΖΔΫχ––Θ§”…”ΎΠΛH>0Θ§‘ρΗΟΖ¥”ΠΡήΙΜΉ‘ΖΔΫχ––ΒΡ‘≠“ρ «ΠΛS>0ΘΜ
CO2(g)+3H2(g) Θ§ΠΛH=+49.5 kJ/mol>0Θ§ΗΟΖ¥”ΠΒΡ’ΐΖ¥”Π «ΤχΧεΧεΜΐ‘ω¥σΒΡΖ¥”ΠΘ§ΗυΨίΖ¥”ΠΉ‘ΖΔΫχ––ΒΡ≈–Εœ“άΨίΠΛG=ΠΛH-TΠΛS<0Θ§»τΖ¥”ΠΡήΙΜΉ‘ΖΔΫχ––Θ§”…”ΎΠΛH>0Θ§‘ρΗΟΖ¥”ΠΡήΙΜΉ‘ΖΔΫχ––ΒΡ‘≠“ρ «ΠΛS>0ΘΜ
ΔΎΗυΨίΆΦ ΨΩ…÷ΣΘΚ‘ΎœύΆ§Έ¬Ε»œ¬¥ΏΜ·ΦΝCuAl2O4±»¥ΏΜ·ΦΝCu/Zn/AlΒΡ¥ΏΜ·Μν–‘ΗΏΘ§«“ Ι”ΟΫœ≥Λ ±ΦδΚσΘ§ΜΙΡή±Θ≥÷ΫœΗΏΒΡΜν–‘Θ§“ρ¥Υ¥ΏΜ·ΦΝCuAl2O4±»¥ΏΜ·ΦΝCu/Zn/AlΗϋΚΟΘΜ
Δέ”…”ΎKsp[Cu(OH)2]=2.2ΓΝ10-20Θ§‘ρCu2+–Έ≥…≥ΝΒμ–η“Σc(OH-)=![]() =4.7ΓΝ10-8 mol/LΘΜ”…”ΎKsp[Al(OH)3]=1.3ΓΝ10-33Θ§‘ρAl3+–Έ≥…≥ΝΒμ–η“Σc(OH-)=
=4.7ΓΝ10-8 mol/LΘΜ”…”ΎKsp[Al(OH)3]=1.3ΓΝ10-33Θ§‘ρAl3+–Έ≥…≥ΝΒμ–η“Σc(OH-)=![]() =5.1ΓΝ10-10 mol/LΓΘœ‘»ΜAl3+Άξ»Ϊ–Έ≥…≥ΝΒμ–η“Σ»ή“ΚΒΡc(OH-)Ϋœ–ΓΓΘœρCu(NO3)2ΓΔAl(NO3)3ΜλΚœ»ή“Κ÷–ΒΈΦ”NaOH»ή“ΚΩ…ΜώΒΟ≥ΝΒμΈο[Cu(OH)2ΓΔAl(OH)3]Θ§“‘±ψ”Ύ÷Τ»ΓCuAl2O4ΓΘΈΣ»Ζ±ΘCu2+ΓΔAl3ΘΪΆξ»Ϊ≥ΝΒμΘ§”ΠΗΟΗυΨίCu2+–Έ≥…≥ΝΒμ–η“ΣΒΡpHΫχ––≈–ΕœΘ§c(H+)=
=5.1ΓΝ10-10 mol/LΓΘœ‘»ΜAl3+Άξ»Ϊ–Έ≥…≥ΝΒμ–η“Σ»ή“ΚΒΡc(OH-)Ϋœ–ΓΓΘœρCu(NO3)2ΓΔAl(NO3)3ΜλΚœ»ή“Κ÷–ΒΈΦ”NaOH»ή“ΚΩ…ΜώΒΟ≥ΝΒμΈο[Cu(OH)2ΓΔAl(OH)3]Θ§“‘±ψ”Ύ÷Τ»ΓCuAl2O4ΓΘΈΣ»Ζ±ΘCu2+ΓΔAl3ΘΪΆξ»Ϊ≥ΝΒμΘ§”ΠΗΟΗυΨίCu2+–Έ≥…≥ΝΒμ–η“ΣΒΡpHΫχ––≈–ΕœΘ§c(H+)=![]() mol/L=2.13ΓΝ10-7 mol/LΘ§pHΓ÷7Θ§Ι ”ΠΩΊ÷ΤΜλΚœ“ΚpHΒΡΉν–Γ’ϊ ΐ÷ΒΈΣ7ΓΘ
mol/L=2.13ΓΝ10-7 mol/LΘ§pHΓ÷7Θ§Ι ”ΠΩΊ÷ΤΜλΚœ“ΚpHΒΡΉν–Γ’ϊ ΐ÷ΒΈΣ7ΓΘ
(2)‘ΎΖ¥”Π2÷–Θ§Ζ¥”ΠΈο «HCOO-Θ§…ζ≥…Έο «H-ΚΆMΘ§ΗυΨίΒγΚ… ΊΚψΦΑ‘ΣΥΊ ΊΚψΘ§Ω…÷ΣMΒΡΜ·―ß ΫΈΣCO2ΘΜ‘ΎΖ¥”Π1÷–‘ΣΥΊΜ·ΚœΦέΖΔ…ζ±δΜ·ΒΡ‘ΣΥΊ”–CΓΔN‘ΣΥΊΘΜ‘ΎΖ¥”Π2÷–‘ΣΥΊΜ·ΚœΦέΖΔ…ζ±δΜ·ΒΡ‘ΣΥΊ”–HΓΔC‘ΣΥΊΘΜ‘ΎΖ¥”Π3÷–H+ΓΔH-ΫαΚœ–Έ≥…H2Θ§÷Μ”–H‘ΣΥΊΜ·ΚœΦέΖΔ…ζ±δΜ·Θ§“ρ¥ΥΆΦ ΨΖ¥”Π÷–÷Μ”–«β‘ΣΥΊΜ·ΚœΦέΖΔ…ζ±δΜ·ΒΡ «Ζ¥”Π3ΘΜ
(3)ΒγΫβΑ±Υ°ΚΆKOHΜλΚœ»ή“ΚΘ§‘Ύ“θΦΪ…œ»ή“Κ÷–Υ°Βγάκ≤ζ…ζΒΡH+ΒΟΒΫΒγΉ”Θ§±ΜΜΙ‘≠≤ζ…ζH2Θ§ΒγΦΪΖ¥”Π ΫΈΣΘΚ2H++2e-=H2ΓϋΘ§‘Ύ―τΦΪ…œ“ΜΥ°ΚœΑ±ΒΟΒΫΒγΉ”…ζ≥…N2Θ§‘ρ…ζ≥…N2ΒΡΒγΦΪΖ¥”Π ΫΈΣ2NH3ΓΛH2O+6OH--6e-=N2Γϋ+8H2OΘΜ
(4)NH4+ΫΪNOxΜΙ‘≠ΈΣN2Θ§Β±NO”κO2ΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ1ΓΟ1 ±Θ§ΫαΚœΒγΉ” ΊΚψΓΔΒγΚ… ΊΚψΚΆ‘≠Ή” ΊΚψΘ§Ω…ΒΟΗΟΖ¥”ΠΒΡΖΫ≥Χ ΫΈΣΘΚ4NH4++2NO+2O2=3N2+6H2O+4H+ΓΘ


 Ή÷¥ ΨδΤΣ”κΆ§≤ΫΉςΈΡ¥ο±ξœΒΝ–¥πΑΗ
Ή÷¥ ΨδΤΣ”κΆ§≤ΫΉςΈΡ¥ο±ξœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Υ δΤϊ”ΆΒΡ≥ΒΝΨΘ§Χυ”–ΒΡΈΘœ’Μ·―ßΤΖ±ξ÷Ψ «
A. B.
B. C.
C. D.
D.
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩν―(Ti)±Μ≥ΤΈΣΓΑΈ¥ά¥Ϋπ τΓ±Θ§ΙψΖΚ”Π”Ο”ΎΙζΖάΓΔΚΫΩ’ΚΫΧλΓΔ…ζΈο≤ΡΝœΒ»Νλ”ρΓΘν―ΒΡ¬»Μ·Έο”–»γœ¬ΉΣ±δΙΊœΒΘΚ2TiCl3![]() TiCl4Γϋ+TiCl2ΜΊ¥πœ¬Ν–Έ ΧβΓΘ
TiCl4Γϋ+TiCl2ΜΊ¥πœ¬Ν–Έ ΧβΓΘ
(1)Ρ≥Ά§―ßΥυΜ≠ΜυΧ§ Cl-ΒΡΆβΈßΒγΉ”≈≈≤ΦΆΦΈΣ![]() Θ§’βΈΞΖ¥ΝΥ____________
Θ§’βΈΞΖ¥ΝΥ____________
(2)¥”ΫαΙΙΫ«Ε»Ϋβ Ά TiCl3÷–Ti(III)ΜΙ‘≠–‘Ϋœ«ΩΒΡ‘≠“ρ____________ΓΘ
(3)ν―ΒΡ¬»Μ·ΈοΒΡ≤ΩΖ÷Έοάμ–‘÷ »γœ¬±μΘΚ
¬»Μ·Έο | »έΒψ/Γφ | Ζ–Βψ/Γφ | »ήΫβ–‘ |
TiCl4 | -24 | 136 | Ω…»ή”ΎΖ«ΦΪ–‘ΒΡΦΉ±ΫΚΆ¬»¥ζΧΰ |
TiCl2 | 1035 | 1500 | ≤Μ»ή”Ύ¬»Ζ¬ΓΔ““Ο― |
ΔΌTiCl4”κTiCl2ΒΡΨßΧεάύ–ΆΖ÷±π «____________ΓΘ
ΔΎTiCl4”κSO42-ΜΞΈΣΒ»ΒγΉ”ΧεΘ§“ρΈΣΥϋΟ«____________œύΆ§ΘΜSO42-÷––Ρ‘≠Ή”“‘3sΙλΒάΚΆ3pΙλΒά‘”Μ·ΓΘ
(4)TiΒΡ≈δΚœΈο”–Εύ÷÷ΓΘTi(CO)6ΓΔTi(H2O)63+ΓΔTiF62-ΒΡ≈δΧεΥυΚ§‘≠Ή”÷–ΒγΗΚ–‘Ήν–ΓΒΡ «__________ΘΜTi(NO3)4ΒΡ«ρΙςΫαΙΙ»γΆΦΘ§TiΒΡ≈δΈΜ ΐ «_____________
(5)ΗΤν―Ωσ(CaTiO3) «Ή‘»ΜΫγ÷–ΒΡ“Μ÷÷≥ΘΦϊΩσΈοΘ§ΤδΨßΑϊΫαΙΙ»γΆΦΘΚ
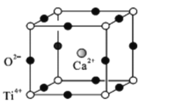
ΔΌ…ηNΈΣΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΘ§ΦΤΥψ“ΜΗωΨßΑϊΒΡ÷ ΝΩΈΣ______________g.
ΔΎΦΌ…ηO2-≤…”ΟΟφ–ΡΝΔΖΫΉνΟήΕ―ΜΐΘ§Ti4+”κO2-œύ«–Θ§‘ρ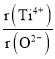 =_________ΓΘ
=_________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΗυΨίœ¬Ν–ΆΦ ΨΥυΒΟ≥ωΒΡΫα¬έ’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©
A.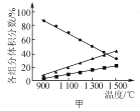 ΆΦΦΉ±μ ΨH2SΘ®gΘ© ή»»Ζ÷Ϋβ ±ΗςΉιΖ÷ΧεΜΐΖ÷ ΐΥφΖ¥”ΠΈ¬Ε»ΒΡ±δΜ·ΙΊœΒΘ§ΥΒΟςΖ¥”Π…ζ≥…H2ΚΆS
ΆΦΦΉ±μ ΨH2SΘ®gΘ© ή»»Ζ÷Ϋβ ±ΗςΉιΖ÷ΧεΜΐΖ÷ ΐΥφΖ¥”ΠΈ¬Ε»ΒΡ±δΜ·ΙΊœΒΘ§ΥΒΟςΖ¥”Π…ζ≥…H2ΚΆS
B.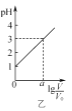 ΆΦ““±μ ΨV0 mL 0.1 molΓΛLΘ≠1ΒΡ―ΈΥαΦ”Υ°œΓ Ά÷ΝV mLΘ§»ή“ΚΒΡpHΥφlg
ΆΦ““±μ ΨV0 mL 0.1 molΓΛLΘ≠1ΒΡ―ΈΥαΦ”Υ°œΓ Ά÷ΝV mLΘ§»ή“ΚΒΡpHΥφlg![]() ΒΡ±δΜ·ΙΊœΒΘ§‘ρaΘΫ2
ΒΡ±δΜ·ΙΊœΒΘ§‘ρaΘΫ2
C.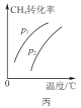 ΆΦ±ϊ±μ ΨΟή±’»ίΤς÷–CH4Θ®gΘ©ΘΪH2OΘ®gΘ©
ΆΦ±ϊ±μ ΨΟή±’»ίΤς÷–CH4Θ®gΘ©ΘΪH2OΘ®gΘ©![]() COΘ®gΘ©ΘΪ3H2Θ®gΘ©ΒΫ¥οΤΫΚβ ±Θ§CH4ΒΡΉΣΜ·¬ ”κ―Ι«ΩΓΔΈ¬Ε»ΒΡ±δΜ·ΙΊœΒ«ζœΏΘ§ΥΒΟςp1ΘΨp2
COΘ®gΘ©ΘΪ3H2Θ®gΘ©ΒΫ¥οΤΫΚβ ±Θ§CH4ΒΡΉΣΜ·¬ ”κ―Ι«ΩΓΔΈ¬Ε»ΒΡ±δΜ·ΙΊœΒ«ζœΏΘ§ΥΒΟςp1ΘΨp2
D. ΆΦΕΓ±μ ΨΧΩΚΎΉς”Οœ¬O2…ζ≥…ΜνΜ·―θΙΐ≥Χ÷–ΡήΝΩ±δΜ·«ιΩωΘ§ΥΒΟςΟΩΜνΜ·“ΜΗω―θΖ÷Ή”Έϋ ’0.29 eVΒΡΡήΝΩ
ΆΦΕΓ±μ ΨΧΩΚΎΉς”Οœ¬O2…ζ≥…ΜνΜ·―θΙΐ≥Χ÷–ΡήΝΩ±δΜ·«ιΩωΘ§ΥΒΟςΟΩΜνΜ·“ΜΗω―θΖ÷Ή”Έϋ ’0.29 eVΒΡΡήΝΩ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–άκΉ”ΉιΦ”»κœύ”Π ‘ΦΝΚσΘ§ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ’ΐ»ΖΒΡ «(ΓΓΓΓΘ©
άκΉ”Ήι | Φ”»κ ‘ΦΝ | άκΉ”ΖΫ≥Χ Ϋ | |
A | NaΘΪΓΔ | Ba(OHΘ©2»ή“Κ | 2NaΘΪΘΪ |
B | HΘΪΓΔClΘ≠ | ΉψΝΩ ·Μ“»ι | 2HΘΪΘΪ2OHΘ≠=2H2O |
C | KΘΪΓΔ | NaHSO4»ή“Κ |
|
D | AgΘΪΓΔ | …ΌΝΩ―ΈΥα | AgΘΪΘΪ |
A.AB.BC.CD.D
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ““Υα’ΐΕΓθΞ(CH3CH2CH2CH2OOCCH3) «“Μ÷÷”≈ΝΦΒΡ”–Μζ»ήΦΝΓΘ Β―ι “÷Τ±Η…ΌΝΩ““Υα’ΐΕΓθΞΒΡΖ¥”ΠΈΣCH3COOH+CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OOCCH3+H2OΓΘ
CH3CH2CH2CH2OOCCH3+H2OΓΘ
Β―ι≤Ϋ÷η»γœ¬ΘΚ
≤Ϋ÷η1ΘΚœρ“«ΤςA÷–Φ”»κ11.5 mL’ΐΕΓ¥Φ(ΈΔ»ή”ΎΥ°)ΓΔ1 mL≈®H2SO4ΓΔ7.2 mL±υ¥ΉΥαΦΑΖ– ·…Ό–μΓΘ
≤Ϋ÷η2ΘΚΑ¥»γΆΦΝ§Ϋ”ΉΑ÷ΟΓΘ
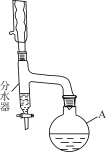
≤Ϋ÷η3ΘΚœρΖ÷Υ°Τς÷–‘Λœ»Φ”…ΌΝΩΥ°(¬‘ΒΆ”Ύ÷ßΙήΩΎ)ΓΘΆ®»κά以հȧ֔»»ΜΊΝςΓΘ
≤Ϋ÷η4ΘΚΫΪΖ÷Υ°ΤςΖ÷≥ωΒΡθΞ≤ψΚΆΖ¥”Π“ΚΚœ≤ΔΉΣ»κΖ÷“Κ¬©ΕΖ÷–Θ§“ά¥Έ”Ο5% Na2CO3»ή“ΚΓΔΥ°œ¥Β”Θ§Ζ÷άκ≥ω”–ΜζœύΓΘ
≤Ϋ÷η5ΘΚΫΪ”–Μζœύ”ΟΈόΥ°ΝρΥαΟΨΗ…‘οΓΔΙΐ¬ΥΓΔ’τΝσΘ§ ’Φ·““Υα’ΐΕΓθΞΓΘ
(1)“«ΤςAΒΡΟϊ≥Τ «________ΘΜœρΤδ÷–Φ”»κΥι¥…Τ§ΒΡΡΩΒΡ «________ΓΘ
(2)ΉΑ÷Ο÷–Ζ÷Υ°ΤςΒΡΉς”Ο «________Θ§≈–ΕœΖ¥”Π“―Ψ≠Άξ≥…ΒΡ±ξ÷Ψ «________ΓΘ
(3)Ζ¥”Π ±…ζ≥…ΒΡ÷ς“Σ”–ΜζΗ±≤ζΈο”–ΕΓΟ―ΚΆ________(”ΟΫαΙΙΦρ Ϋ±μ Ψ)ΓΘ
(4)≤Ϋ÷η4÷–Θ§Ζ÷άκ≥ω”–ΜζœύΒΡΨΏΧε≤ΌΉς «___________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΜ·ΚœΈο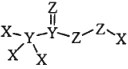 «“Μ÷÷ΗΏ–ßœϊΕΨΦΝΘ§Τδ’τΤϊΚΆ»ή“ΚΕΦΨΏ”–Κή«ΩΒΡ…±ΨζΡήΝΠΘ§Ω…”Ο”ΎΡΩ«Α–¬ΙΎ≤ΓΕΨ“Ώ«ιœ¬ΒΡ…ζΜνœϊΕΨΓΘΤδ÷–XΓΔYΓΔZ ΈΣ‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΒΡΕΧ÷ήΤΎ‘ΣΥΊΓΘœ¬Ν––π ω’ΐ»ΖΒΡ «
«“Μ÷÷ΗΏ–ßœϊΕΨΦΝΘ§Τδ’τΤϊΚΆ»ή“ΚΕΦΨΏ”–Κή«ΩΒΡ…±ΨζΡήΝΠΘ§Ω…”Ο”ΎΡΩ«Α–¬ΙΎ≤ΓΕΨ“Ώ«ιœ¬ΒΡ…ζΜνœϊΕΨΓΘΤδ÷–XΓΔYΓΔZ ΈΣ‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΒΡΕΧ÷ήΤΎ‘ΣΥΊΓΘœ¬Ν––π ω’ΐ»ΖΒΡ «
A.‘≠Ή”ΑκΨΕΘΚX>Y>Z
B.‘ΣΥΊΒΡΖ«Ϋπ τ–‘ΘΚX<Y<Z
C.ΗΟΜ·ΚœΈο÷–ZΒΡΜ·ΚœΦέΨυ≥ -2 Φέ
D.ΗΟΜ·ΚœΈο÷– XΓΔYΓΔZΕΦ¬ζΉψ 8 ΒγΉ”Έ»Ε®ΫαΙΙ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΗςΉι ΐΨί÷–Θ§«Α’ΏΗ’ΚΟ «Κσ’ΏΝΫ±ΕΒΡ « (ΓΓΓΓ)
A. 2 mol H2OΒΡΡΠΕϊ÷ ΝΩΚΆ1 mol H2OΒΡΡΠΕϊ÷ ΝΩ
B. 200 mL 1 molΓΛL-1¬»Μ·ΗΤ»ή“Κ÷–c(Cl-)ΚΆ100 mL 2 molΓΛL-1¬»Μ·ΦΊ»ή“Κ÷–c(Cl-)
C. 64 gΕΰ―θΜ·Νρ÷–―θ‘≠Ή” ΐΚΆ±ξΉΦΉ¥Ωωœ¬22.4 L“Μ―θΜ·ΧΦ÷–―θ‘≠Ή” ΐ
D. 20% NaOH»ή“Κ÷–NaOHΒΡΈο÷ ΒΡΝΩ≈®Ε»ΚΆ10% NaOH»ή“Κ÷–NaOHΒΡΈο÷ ΒΡΝΩ≈®Ε»
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΑ¥“Σ«σΆξ≥…œ¬Ν–ΧνΩ’ΘΚ
Θ®1Θ©«β―θΜ·¬Ν‘ΎΦν–‘»ή“Κ÷–ΒΡΒγάκΖΫ≥Χ ΫΈΣ_____ΓΘ
Θ®2Θ©œρFeSO4»ή“Κ÷–Φ”ΦΗΒΈΝρ«ηΜ·ΦΊ»ή“ΚΘ§Έόœ÷œσΘ§‘ΌΒΈΦ””ΟΝρΥαΥαΜ·ΙΐΒΡH2O2Θ§»ή“Κ±δΚλΓΘ–¥≥ωœύ”ΠΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ_____Θ§_____ΓΘ
Θ®3Θ©”“ΈΣΡ≥ΧΰΒΡ«ρΙςΡΘ–Ά Θ§ΤδΟϊ≥ΤΘ®œΒΆ≥ΟϋΟϊΖ®Θ© «_____
Θ§ΤδΟϊ≥ΤΘ®œΒΆ≥ΟϋΟϊΖ®Θ© «_____
“‘œ¬–¥≥ωœύ”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ
Θ®4Θ©¬ΝΖέ”κΕΰ―θΜ·ΟΧΜλΚœΈο‘ΎΗΏΈ¬œ¬Ζ¥”Π_____
Θ®5Θ©«β―θΜ·―«Χζ÷Ο”Ύ≥± ΣΒΡΩ’Τχ÷–_____
Θ®6Θ©œρ“―ΥαΜ·ΒΡFeCl3»ή“Κ÷–Φ”»κΆ≠Ζέ_____
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com