
ЁОЬтФПЁПюб(Ti)БЛГЦЮЊЁАЮДРДН№ЪєЁБЃЌЙуЗКгІгУгкЙњЗРЁЂКНПеКНЬьЁЂЩњЮяВФСЯЕШСьгђЁЃюбЕФТШЛЏЮягаШчЯТзЊБфЙиЯЕЃК2TiCl3![]() TiCl4Ёќ+TiCl2ЛиД№ЯТСаЮЪЬтЁЃ
TiCl4Ёќ+TiCl2ЛиД№ЯТСаЮЪЬтЁЃ
(1)ФГЭЌбЇЫљЛЛљЬЌ Cl-ЕФЭтЮЇЕчзгХХВМЭМЮЊ![]() ЃЌетЮЅЗДСЫ____________
ЃЌетЮЅЗДСЫ____________
(2)ДгНсЙЙНЧЖШНтЪЭ TiCl3жаTi(III)ЛЙдадНЯЧПЕФдвђ____________ЁЃ
(3)юбЕФТШЛЏЮяЕФВПЗжЮяРэаджЪШчЯТБэЃК
ТШЛЏЮя | ШлЕу/Ёц | ЗаЕу/Ёц | ШмНтад |
TiCl4 | -24 | 136 | ПЩШмгкЗЧМЋадЕФМзБНКЭТШДњЬў |
TiCl2 | 1035 | 1500 | ВЛШмгкТШЗТЁЂввУб |
ЂйTiCl4гыTiCl2ЕФОЇЬхРраЭЗжБ№ЪЧ____________ЁЃ
ЂкTiCl4гыSO42-ЛЅЮЊЕШЕчзгЬхЃЌвђЮЊЫќУЧ____________ЯрЭЌЃЛSO42-жааФдзгвд3sЙьЕРКЭ3pЙьЕРдгЛЏЁЃ
(4)TiЕФХфКЯЮягаЖржжЁЃTi(CO)6ЁЂTi(H2O)63+ЁЂTiF62-ЕФХфЬхЫљКЌдзгжаЕчИКадзюаЁЕФЪЧ__________ЃЛTi(NO3)4ЕФЧђЙїНсЙЙШчЭМЃЌTiЕФХфЮЛЪ§ЪЧ_____________
(5)ИЦюбПѓ(CaTiO3)ЪЧздШЛНчжаЕФвЛжжГЃМћПѓЮяЃЌЦфОЇАћНсЙЙШчЭМЃК
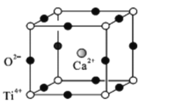
ЂйЩшNЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌМЦЫувЛИіОЇАћЕФжЪСПЮЊ______________g.
ЂкМйЩшO2-ВЩгУУцаФСЂЗНзюУмЖбЛ§ЃЌTi4+гыO2-ЯрЧаЃЌдђ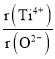 =_________ЁЃ
=_________ЁЃ
ЁОД№АИЁПХнРћдРэ +3МлTiЭтЮЇЕчзгЮЊ3d1ЃЌЪЇШЅвЛИіЕчзгКѓЃЌ3dФмМЖДІгкШЋПеЮШЖЈзДЬЌ ЗжзгОЇЬхЃЛРызгОЇЬх дзгзмЪ§ЁЂМлЕчзгзмЪ§ H 8 ![]()
![]() -1Лђ0.414
-1Лђ0.414
ЁОНтЮіЁП
(1)ИљОндзгКЫЭтЕчзгХХВМЙцТЩЗжЮіЃЛ
(2)ИљОндзгКЫЭтИїИіЕчзгВуХХВМДІгкШЋТњЁЂАыТњЛђШЋПеЪБЮШЖЈЗжЮіЃЛ
(3)ЂйИљОнЗжзгОЇЬхШлЗаЕуЕЭЃЌвзШмгкФГаЉШмМСжаЃЌЖјРызгОЇЬхШлЗаЕуНЯИпЃЌдкгаЛњШмМСжаВЛФмШмНтЗжЮіХаЖЯЃЛ
ЂкИљОнЕШЕчзгЬхЕФИХФюМАаджЪЗжЮіХаЖЯЃЛ
(4)дЊЫиЕФЗЧН№ЪєаддНШѕЃЌдЊЫиЕФЕчИКадОЭдНаЁЃЛНсКЯЭМЪОжагыTiаЮГЩЙВМлМќЕФдзгЪ§ФПШЗЖЈЦфХфЮЛЬхЪ§ФПЃЛ
(5)ЂйгУОљЬЏЗНЗЈМЦЫувЛИіОЇАћжаКЌгаЕФИїжждЊЫиЕФдзгИіЪ§ЃЌШЛКѓНсКЯФІЖћжЪСПгыЯрЖддзгжЪСПЙиЯЕМЦЫуОЇАћжЪСПЃЛ
ЂкO2-ВЩгУУцаФСЂЗНЖбЛ§ЃЌдђИїжжРызгЯрЖдЮЛжУПЩБэЪОЮЊЃК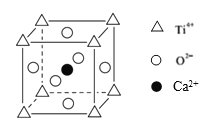 ЃЌУцЖдНЧЯпЮЊ2ИіO2-АыОЖгы2ИіTi4+ЕФАыОЖЃЌОЇАћБпГЄЮЊ2ИіO2-АыОЖЃЌОнДЫЗжЮіНтД№ЁЃ
ЃЌУцЖдНЧЯпЮЊ2ИіO2-АыОЖгы2ИіTi4+ЕФАыОЖЃЌОЇАћБпГЄЮЊ2ИіO2-АыОЖЃЌОнДЫЗжЮіНтД№ЁЃ
(1)ClЪЧ17КХдЊЫиЃЌКЫЭтЕчзгХХВМЮЊ2ЁЂ8ЁЂ7ЃЌClдзгЛёЕУ1ИіЕчзгБфЮЊCl-ЃЌИљОнЙЙдьдРэЃЌЛљЬЌCl-КЫЭтЕчзгХХВМЪНЪЧ1s22s22p63s23p6ЃЌ3pбЧВуга3ИіФмСПЯрЭЌЕФЙьЕРЃЌУПИіЙьЕРзюЖрШнФЩ2Иізда§ЗНЯђЯрЗДЕФЕчзгЃЌетбљХХВМЪЙРызгФмСПзюЕЭЃЌЮШЖЈЃЌЙЪЛљЬЌ Cl-ЕФЭтЮЇЕчзгХХВМЭМЮЊ![]() ЃЌЖј
ЃЌЖј![]() дђЮЅБГСЫХнРћВЛЯрШндРэЃЛ
дђЮЅБГСЫХнРћВЛЯрШндРэЃЛ
(2)TiЪЧ22КХдЊЫиЃЌЭтЮЇЕчзгХХВМЪЧ3d24s2ЃЌTiCl3жаTiЕФЛЏКЯМлЮЊ+3МлЃЌ+3МлTiЭтЮЇЕчзгЮЊ3d1ЃЌЕБЦфдйЪЇШЅвЛИіЕчзгКѓЃЌ3dФмМЖДІгкШЋПеЕФЮШЖЈзДЬЌЃЌвђДЫTiCl3жаTi(III)ЛЙдадНЯЧПЃЛ
(3)ИљОнБэИёаджЪПЩжЊTiCl4ШлЗаЕуЕЭЃЌвзШмгкгаЛњШмМСЃЌдђTiCl4ЪЧгЩЗжзгЙЙГЩЕФЗжзгОЇЬхЃЛЖјTiCl2ШлЗаЕуНЯИпЃЌдкввДМЁЂввУбжаВЛФмШмНтЃЌЫЕУїTiCl2ЕФОЇЬхРраЭЪєгкРызгОЇЬхЃЛ
ЂкTiCl4гыSO42-ЕФдзгзмЪ§ЁЂМлЕчзгзмЪ§ЯрЕШЃЌвђДЫЖўепЛЅЮЊЕШЕчзгЬхЃЛ
(4)дкTiЕФЖржжХфКЯЮяTi(CO)6ЁЂTi(H2O)63+ЁЂTiF62-жаЃЌХфЬхЗжБ№ЪЧCOЁЂH2OЁЂF-ЃЌЦфжаКЌгаЕФЗЧН№ЪєаддЊЫигаCЁЂOЁЂHЁЂFЃЌдЊЫиЕФЗЧН№ЪєадЃКF>O>C>HЃЌдЊЫиЕФЗЧН№ЪєаддНШѕЃЌЦфЕчИКадОЭдНаЁЃЌЙЪЩЯЪіЫљКЌЗЧН№ЪєдЊЫидзгжаЕчИКадзюаЁЕФЪЧHЃЛИљОнTi(NO3)4ЕФЧђЙїНсЙЙЭМЪОПЩжЊTiЕФХфЮЛЪ§ЪЧ8ЃЛ
(5)ЂйдквЛИіОЇАћжаКЌгаCa2+РызгЪ§ФПЪЧ1ЃЛКЌгаTi4+РызгЪ§ФПЮЊ8![]() =1ЃЌКЌгаЕФO2-Ъ§ФПЮЊ12
=1ЃЌКЌгаЕФO2-Ъ§ФПЮЊ12![]() =3ЃЌдђвЛИіОЇАћжаКЌга1ИіCaTiO3ЃЌЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌдђвЛИіОЇАћЕФжЪСПЮЊ
=3ЃЌдђвЛИіОЇАћжаКЌга1ИіCaTiO3ЃЌЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌдђвЛИіОЇАћЕФжЪСПЮЊ![]() =
=![]() gЃЛ
gЃЛ
ЂкМйЩшO2-ВЩгУУцаФСЂЗНзюУмЖбЛ§ЃЌ Ti4+гыO2-ЯрЧаЃЌдђОЇАћБпГЄЮЊL=2r(O2-)ЃЌОЇАћЕФУцЖдНЧЯп
Ti4+гыO2-ЯрЧаЃЌдђОЇАћБпГЄЮЊL=2r(O2-)ЃЌОЇАћЕФУцЖдНЧЯп![]() L=2r(O2-)+2r(Ti4+)ЃЌЙЪr(O2-)=
L=2r(O2-)+2r(Ti4+)ЃЌЙЪr(O2-)=![]() LЃЌr(Ti4+)=
LЃЌr(Ti4+)=![]() L-
L-![]() L ЃЌЫљвд
L ЃЌЫљвд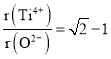 =0.404ЁЃ
=0.404ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПжЦБИаПгЁЫЂЕчТЗАхЪЧгУЯЁЯѕЫсИЏЪДаПАхВњЩњЕФЗЯвКГЦЁАРУАхвКЁБЁЃЁАРУАхвКЁБжаГ§КЌЯѕЫсаПЭтЃЌЛЙКЌгаздРДЫЎДјШыЕФClЃКЭFe3+ЃЌдкЪЕбщЪвРяЃЌгУЁАРУАхвКжЦШЁZnSO47HOЕФЙ§ГЬШчЭМЫљЪО
ЃЈ1ЃЉШєЯЁЯѕЫсИЏЪДаПАхЪБЛЙдВњЮяЮЊN2OЃЌбѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЪЧ_________
ЃЈ2ЃЉШєВНжшЂйЕФpHЃО12ЃЌдђZn(OH) 2ШмНтЩњГЩЦЋаПЫсФЦЃЌZn(OH) 2ШмНтЕФРызгЗНГЬЪНЮЊ___________________________
ЃЈ3ЃЉТЫвКDжаГ§СЫКЌгаOHЃРызгЭтЃЌЛЙКЌгаЕФвѕРызгга___________ЃЈЬюРызгЗћКХЃЉ
ЃЈ4ЃЉШєТЫвКEЕФpHЃН4ЃЌcЃЈZn2ЃЋЃЉЃН2molЁЄL-1,ЃЈFe3ЃЋЃЉЃН2.6ЁС10-9moЁЄL-lЪдЧѓГіFeЃЈOHЃЉ3ЕФШмЖШЛ§ГЃЪ§________________ЃЈжЛаДНсЙћЃЉ
ЃЈ5ЃЉвбжЊ:ЂйFeЃЈOHЃЉ3ЃЈsЃЉ Fe3ЃЋЃЈaqЃЉЃЋ3OHЃЃЈaqЃЉHЃНa kJ molЁЄL-1
ЂкH2O(l) HЃЋЃЈaqЃЉЃЋOHЃЃЈaqЃЉHЃНb kJЁЄmolЁЄL-1
ШєЂйЕФШмЖШЛ§ГЃЪ§ЮЊKspЃЌЂкЕФРызгЛ§ГЃЪ§ЮЊKwЃЌFe3ЃЋЗЂЩњЫЎНтЗДгІЕФЦНКтГЃЪ§:KЃН______________ЃЈгУКЌKwЁЂKspЕФДњЪ§ЪНБэЪОЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
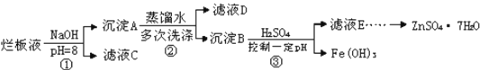
ЁОЬтФПЁПаПУЬИЩЕчГиЕФИКМЋВФСЯЪЧЕчГиПЧЬхЕФН№ЪєаПЃЌе§МЋЪЧБЛЖўбѕЛЏУЬКЭЬМЗлАќЮЇЕФЪЏФЋЕчМЋЃЌЕчНтжЪЪЧТШЛЏаПКЭТШЛЏяЇЕФК§зДЮяЃЌИУЕчГиЗХЕчЙ§ГЬжаВњЩњMn2O3ЁЃРћгУЗЯОЩЕчГиЛиЪеZnЁЂMnЛЏКЯЮяЃЌЖдЛЗОГБЃЛЄвтвхжиДѓЁЃ
ВНжшвЛЃКЯђГ§ШЅПЧЬхМАЪЏФЋЕчМЋЕФКкЩЋК§зДЮяжаМгЫЎЃЌНСАшЃЌГфЗжШмНтЃЌОЙ§ТЫЗжРыЕУЕНЙЬЬхКЭТЫвКЁЃ
ВНжшЖўЃКДІРэЙЬЬхЃЌЬсШЁMnO2ЭЈЙ§ЖдЛёЕУЕФТЫдќНјаазЦЩеЃЌзЦЩеЕФФПЕФЪЧ__ЁЃзЦЩеЪБгУЕНЕФЪЕбщвЧЦїгаОЦОЋЕЦЁЂВЃСЇАєЁЂ__ЁЃ
ВНжшШ§ЃКДІРэТЫвКЃЌЕУЕНZnCl2ЁЄxH2OОЇЬхЃЌдйЭЈЙ§НЋSOCl2гыZnCl2ЁЄxH2OОЇЬхЛьКЯПЩжЦШЁЮоЫЎZnCl2ЁЃгаЙиЕФЪЕбщзАжУШчЭМЃЈМаГжМАМгШШзАжУТдЃЉЃК
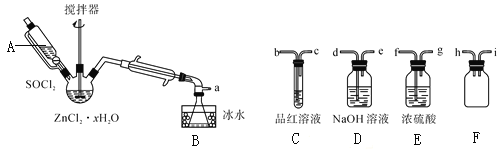
вбжЊЃКSOCl2ЪЧвЛжжГЃгУЕФЭбЫЎМСЃЌШлЕу-105ЁцЃЌЗаЕу79ЁцЁЃ140ЁцвдЩЯвзЗжНтЃЌгыЫЎОчСвЗДгІЩњГЩСНжжЦјЬхЁЃ
ЂйвЧЦїAЕФУћГЦЮЊ__ЁЃ
ЂкеєСѓЩеЦПжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃК__ЁЃ
ЂлЮЊЛиЪеЪЃгрЕФSOCl2ВЂбщжЄЩњГЩЮяжаКЌгаSO2ЁЃЩЯЪівЧЦїНгФПЕФСЌНгЯьађЮЊaЁњ__ЁЃзАжУEжаХЈСђЫсЕФзїгУ___ЁЃ
ЂмЮЊЬсИпSOCl2ЕФРћгУТЪЃЌИУЪЕбщвЫВЩгУЕФМгШШЗНЪНЮЊ__ЁЃ
ЂнЬжТлЃКНЋZnCl2ЁЄxH2OОЇЬхжУгклсліжаМгШШОљЩеЃЌ__ЃЈФмЃЌВЛФмЃЉЕУЕНЮоЫЎZnCl2ЃЌдвђЪЧ__ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђ100mLNaOHШмвКжаЭЈШывЛЖЈСПЕФCO2ЦјЬхЃЌГфЗжЗДгІКѓЃЌдйЯђЫљЕУШмвКжаж№ЕЮМгШы0.2molЁЄL-1ЕФбЮЫсЃЌВњЩњCO2ЦјЬхЕФЬхЛ§гыЫљМгбЮЫсЬхЛ§жЎМфЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаХаЖЯе§ШЗЕФЪЧ
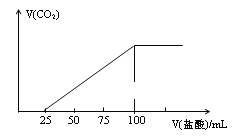
A.ЫљЕУШмвКШмжЪГЩЗжЕФЮяжЪЕФСПжЎБШЮЊЃКn(NaHCO3):n(Na2CO3)=2: 1
B.ЫљЕУШмвКШмжЪГЩЗжЕФЮяжЪЕФСПжЎБШЮЊЃК(NaOH):n(Na2CO3)=1: 3
C.дNaOHШмвКЕФХЈЖШЮЊ0.1mol/L
D.ЭЈШыCO2ЬхЛ§ЮЊ448mL
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЮЊЪвЮТЯТФГЖўдЊЫсH2MШмвКжаH2MЁЂHM-ЁЂM2-ЕФХЈЖШЖдЪ§lgcЫцpHЕФБфЛЏЭМЯѓЁЃЯТСаЗжЮіДэЮѓЕФЪЧ

A.ИУЖўдЊЫсШмвКХЈЖШЮЊ0.010 mol/L
B.pH=1.89ЪБЃЌc(H2M)=c(HM-)>c(M2-)
C.pH=7.0ЪБЃЌlgc(M2-)-lgc(HM-)=0.77
D.дкNaHMШмвКжаЃЌЫЎЕФЕчРыЪмЕНвжжЦ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФПЧАКЌгадЊЫиЮј![]() ЕФБЃНЁЦЗвбПЊЪМгПШыЪаГЁЃЌвбжЊЫќгыбѕЭЌжїзхЃЌЖјгыИЦЭЌжмЦкЃЌЯТСаЙигкЮјЕФгаЙиУшЪіжаВЛе§ШЗЕФЪЧ
ЕФБЃНЁЦЗвбПЊЪМгПШыЪаГЁЃЌвбжЊЫќгыбѕЭЌжїзхЃЌЖјгыИЦЭЌжмЦкЃЌЯТСаЙигкЮјЕФгаЙиУшЪіжаВЛе§ШЗЕФЪЧ
A.дзгађЪ§ЮЊ24B.зюИпМлбѕЛЏЮяЮЊSeO3ЃЌЮЊЫсадбѕЛЏЮя
C.дзгАыОЖБШИЦаЁD.ЦјЬЌЧтЛЏЮяЗжзгЪНЮЊH2SeЃЌЪмШШНЯШнвзЗжНт
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
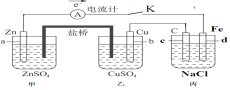
ЁОЬтФПЁПFeCl3ШмвКГЃгУгкЪДПЬЕчТЗАхЃЌЪДПЬКѓЕФЫсадШмвКжаКЌгаCu2ЃЋЁЂFe2ЃЋЁЂFe3ЃЋЁЂClЃЕШЁЃЯТСаИїзщРызгФмдкИУЫсадШмвКжаДѓСПЙВДцЕФЪЧЃЈЁЁЁЁЃЉ
A.NaЃЋЁЂAl3ЃЋЁЂClЃЁЂSO42-B.Ca2ЃЋЁЂMg2ЃЋЁЂNO3-ЁЂClOЃ
C.KЃЋЁЂNH![]() ЁЂSO32-ЁЂAlO2-D.Ba2ЃЋЁЂKЃЋЁЂIЃЁЂNO3-
ЁЂSO32-ЁЂAlO2-D.Ba2ЃЋЁЂKЃЋЁЂIЃЁЂNO3-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧтЦјЪЧвЛжжЧхНрФмдДЃЌЫќЕФжЦШЁгыгІгУвЛжБЪЧШЫРрбаОПЕФШШЕуЁЃ
(1)гУМзДМКЭЫЎеєЦјдкДпЛЏМСЁЂМгШШЬѕМўЯТжЦЧтЕФЯрЙиШШЛЏбЇЗНГЬЪНШчЯТЃК
CH3OH(g)=CO(g)+2H2(g)ЃЛІЄH=+90.7 kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g)ЃЛІЄH=-41.2 kJ/mol
ЂйЗДгІCH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)ФмздЗЂНјааЕФдвђЪЧ________ЁЃ
CO2(g)+3H2(g)ФмздЗЂНјааЕФдвђЪЧ________ЁЃ
ЂкНЋвЛЖЈБШР§ЕФCH3OH(g)КЭH2O(g)ЕФЛьКЯЦјЬхЃЌвдЯрЭЌЫйТЪЭЈЙ§зАгаВЛЭЌДпЛЏМСЕФЗДгІЦїЁЃCH3OHзЊЛЏТЪЫцДпЛЏМСЕФЪЙгУЪБГЄБфЛЏШчЭМ1ЫљЪОЃЌДпЛЏМСCuAl2O4гыДпЛЏМСCu/Zn/AlЯрБШЃЌгХЕуга____________________ЁЃ
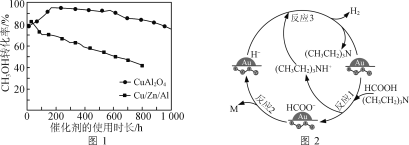
ЂлЯђCu(NO3)2ЁЂAl(NO3)3ЛьКЯШмвКжаЕЮМгNaOHШмвКПЩЛёЕУГСЕэЮя[Cu(OH)2ЁЂAl(OH)3]ЃЌвдБугкжЦШЁCuAl2O4ЁЃЮЊШЗБЃCu2+ЁЂAl3+ЭъШЋГСЕэЃЈХЈЖШЁм10-5 mol/LЃЉЃЌгІПижЦЛьКЯвКpHЕФзюаЁећЪ§жЕЮЊ________{Ksp[Cu(OH)2]=2.2ЁС10-20ЃЌKsp[Al(OH)3]=1.3ЁС10-33}ЁЃ
(2)гУAu/ZrO2зїДпЛЏМСЃЌдк(CH3CH2)3NзїгУЯТHCOOHЗжНтжЦЧтЕФдРэШчЭМ2ЫљЪОЁЃЗДгІ2жаЩњГЩЮяMЕФЛЏбЇЪНЮЊ__________________ЃЌЭМЪОЗДгІжажЛгаЧтдЊЫиЛЏКЯМлЗЂЩњБфЛЏЕФЪЧЗДгІ________ЃЈЬюЁА1ЁБЁА2ЁБЛђЁА3ЁБЃЉЁЃ
(3)ШчЭМЪЧЕчНтАБЫЎКЭKOHЛьКЯШмвКжЦЧтЕФзАжУЪОвтЭМЁЃЩњГЩN2ЕФЕчМЋЗДгІЪНЮЊ______________ЁЃ
(4)ИЛбѕЬѕМўЯТЃЌH2ЛЙдNOxАќРЈСНИіНзЖЮЃКЕквЛНзЖЮЮЊH2ЁЂNOxдкДпЛЏМСзїгУЯТзЊБфЮЊH2OЁЂN2ЁЂNH3ЃЛЕкЖўНзЖЮNH3дкдиЬхЫсЕФзїгУЯТЩњГЩNH4+ЃЌNH4+НЋNOxЛЙдЮЊN2ЁЃаДГіNOгыO2ЕФЮяжЪЕФСПжЎБШЮЊ1ЁУ1ЪБЃЌNH4+гыNOЁЂO2ЗДгІЩњГЩN2ЕФРызгЗДгІЗНГЬЪНЃК__________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМзАжУБеКЯЕчМќKЪБЃЌЕчСїМЦAЕФжИеыНЋЗЂЩњЦЋзЊЁЃЪдЛиД№ЃК
ЃЈ1ЃЉБћГиЪЧ___(ЬюЁАдЕчГиЁБЛђЁАЕчНтГиЁБ)ЁЃ
ЃЈ2ЃЉввжаCuМЋЕФЕчМЋЗДгІЪЧ___ЃЌШєЕчТЗжага0.02molЕчзгЭЈЙ§ЃЌдђМзжаaЕчМЋШмНтЕФжЪСПЮЊ___gЁЃ
ЃЈ3ЃЉБеКЯЕчМќKвЛЖЮЪБМфКѓЃЌБћГижаЩњГЩЖўжжЦјЬхКЭвЛжжМюЃЌдђБћГижаЗЂЩњЕФзмЕФРызгЗДгІЗНГЬЪНЪЧ___ЁЃ
ЃЈ4ЃЉШчЙћвЊИјБћжаЬњЦЌЩЯЖЦЩЯвЛВуAgЃЌдђБћГигІзїКЮИФНј___ЁЃ
ЃЈ5ЃЉБћГижаЗДгІНјааНЯГЄЪБМфКѓЃЌЪеМЏЕНБъзМзДПіЯТЧтЦј2.24LЁЃДЫЪБВтЕУБћГиШмвКжЪСПЪЕМЪМѕЩй4.23gЃЌКЌгаМю0.100mol(ВЛПМТЧЦјЬхдкЫЎжаЕФШмНт)ЃЌдђЪЕМЪЗХГіЦјЬхЕФЮяжЪЕФСПЪЧ___molЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com