
【题目】按要求完成下列填空:
(1)氢氧化铝在碱性溶液中的电离方程式为_____。
(2)向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加用硫酸酸化过的H2O2,溶液变红。写出相应反应的离子方程式_____,_____。
(3)右为某烃的球棍模型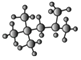 ,其名称(系统命名法)是_____
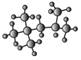
,其名称(系统命名法)是_____
以下写出相应的化学方程式
(4)铝粉与二氧化锰混合物在高温下反应_____
(5)氢氧化亚铁置于潮湿的空气中_____
(6)向已酸化的FeCl3溶液中加入铜粉_____
【答案】Al(OH)3AlO2﹣+H++H2O 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3SCN﹣=Fe(SCN)3 2,2,4 —三甲基戊烷 4Al+3MnO2![]() 2Al2O3+3Mn 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2FeCl3+Cu=CuCl2+2FeCl2
2Al2O3+3Mn 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2FeCl3+Cu=CuCl2+2FeCl2
【解析】
(1)氢氧化铝与NaOH溶液反应生成偏铝酸钠和水,说明氢氧化铝在碱性溶液中能部分电离出偏铝酸根离子和氢离子,则在碱性溶液中的电离方程式为:Al(OH)3AlO2﹣+H++H2O;
(2)在酸性条件下,亚铁离子被过氧化氢氧化为铁离子,发生的离子反应为2Fe2++H2O2+2H+=2Fe3++2H2O,生成的Fe3+在溶液中遇SCN﹣,溶液变红色,发生的离子反应为Fe3++3SCN﹣=Fe(SCN)3;
(3) 的结构简式为(CH3) 3CCH(CH3) 2,根据烷烃的系统命名此烷烃的名称为2,2,4—三甲基戊烷;
的结构简式为(CH3) 3CCH(CH3) 2,根据烷烃的系统命名此烷烃的名称为2,2,4—三甲基戊烷;
(4)铝粉和二氧化锰高温加热,发生铝热反应,生成氧化铝和Mn,反应方程式为4Al+3MnO2![]() 2Al2O3+3Mn;
2Al2O3+3Mn;
(5)氢氧化亚铁与氧气、水反应生成氢氧化铁,发生的化学反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(6)酸化的FeCl3溶液中加入铜粉,生成氯化亚铁和氯化铜,发生反应的化学方程式为2FeCl3+Cu=CuCl2+2FeCl2。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,它的制取与应用一直是人类研究的热点。
(1)用甲醇和水蒸气在催化剂、加热条件下制氢的相关热化学方程式如下:
CH3OH(g)=CO(g)+2H2(g);ΔH=+90.7 kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g);ΔH=-41.2 kJ/mol
①反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)能自发进行的原因是________。
CO2(g)+3H2(g)能自发进行的原因是________。
②将一定比例的CH3OH(g)和H2O(g)的混合气体,以相同速率通过装有不同催化剂的反应器。CH3OH转化率随催化剂的使用时长变化如图1所示,催化剂CuAl2O4与催化剂Cu/Zn/Al相比,优点有____________________。
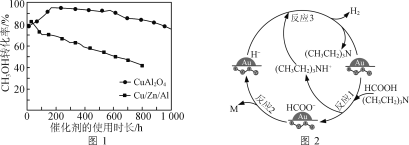
③向Cu(NO3)2、Al(NO3)3混合溶液中滴加NaOH溶液可获得沉淀物[Cu(OH)2、Al(OH)3],以便于制取CuAl2O4。为确保Cu2+、Al3+完全沉淀(浓度≤10-5 mol/L),应控制混合液pH的最小整数值为________{Ksp[Cu(OH)2]=2.2×10-20,Ksp[Al(OH)3]=1.3×10-33}。
(2)用Au/ZrO2作催化剂,在(CH3CH2)3N作用下HCOOH分解制氢的原理如图2所示。反应2中生成物M的化学式为__________________,图示反应中只有氢元素化合价发生变化的是反应________(填“1”“2”或“3”)。
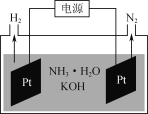
(3)如图是电解氨水和KOH混合溶液制氢的装置示意图。生成N2的电极反应式为______________。
(4)富氧条件下,H2还原NOx包括两个阶段:第一阶段为H2、NOx在催化剂作用下转变为H2O、N2、NH3;第二阶段NH3在载体酸的作用下生成NH4+,NH4+将NOx还原为N2。写出NO与O2的物质的量之比为1∶1时,NH4+与NO、O2反应生成N2的离子反应方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置闭合电键K时,电流计A的指针将发生偏转。试回答:
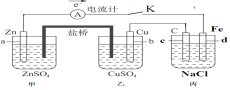
(1)丙池是___(填“原电池”或“电解池”)。
(2)乙中Cu极的电极反应是___,若电路中有0.02mol电子通过,则甲中a电极溶解的质量为___g。
(3)闭合电键K一段时间后,丙池中生成二种气体和一种碱,则丙池中发生的总的离子反应方程式是___。
(4)如果要给丙中铁片上镀上一层Ag,则丙池应作何改进___。
(5)丙池中反应进行较长时间后,收集到标准状况下氢气2.24L。此时测得丙池溶液质量实际减少4.23g,含有碱0.100mol(不考虑气体在水中的溶解),则实际放出气体的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钟南山院士指出,实验证明中药连花清瘟胶囊对治疗新冠肺炎有明显疗效,G是其有效药理成分之一,存在如图转化关系:
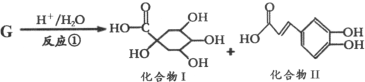
下列有关说法正确的是
A.化合物Ⅱ中所有碳原子可能都共面
B.化合物Ⅰ分子中有3个手性碳原子
C.化合物G、Ⅰ、Ⅱ均能发生氧化反应、取代反应、消去反应
D.若在反应中,G与水按1:1发生反应,则G的分子式为C16H20O10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某元素的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,各物质转化关系如图所示。下列说法正确的是

A. A是可与草木灰混合使用的肥料 B. C可用排空气法收集
C. F和B能发生复分解反应生成盐 D. B在一定条件下可直接与Y反应生成D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中不正确的是

A. 1mol NH4+ 所含的质子总数为10NA
B. 联氨(N2H4)中含有极性键和非极性键
C. 过程II属于氧化反应,过程IV属于还原反应
D. 过程I中,参与反应的NH4+与NH2OH的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)第四周期元素中价层成对电子数与基态Mg价层成对电子数相等的元素有_________种。
(2)吡咯(平面形结构,结构式为![]() ),N原子杂化方式为______。多原子分子中的大π键可用符号
),N原子杂化方式为______。多原子分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______。
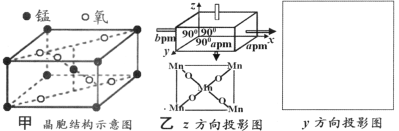
(3)一种锰的氧化物的晶胞如图甲,请写出该氧化物的化学式______。若沿z轴方向观察该晶胞,可得投影图如图乙,请画出沿y轴方向的投影图______。
(4)某含Mg储氢晶体储氢后转化为MgH2,MgH2晶体的结构如图丙,晶胞参数a=b=450pm,c=301pm,原子分数坐标为A(0,0,0)、B(0.305,0.305,0)、C(1,1,1)、D(0.195,0.805,0.5)。
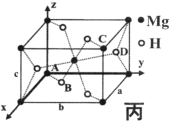
①该晶体中Mg的配位数是__________。
②Mg2+的半径为72pm,则H-的半径为____________pm(列出计算表达式)
③用NA表示阿伏伽德罗常数,则MgH2晶体中氢的密度是标准状况下氢气密度的_______倍(列出计算表达式,氢气密度为0.089g·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取6.00克铝土矿样品(含Al2O3、Fe2O3、SiO2),将其放入盛有100毫升H2SO4溶液的烧杯中,充分反应后滤出沉淀物。在滤液X中加入10摩/升的NaOH溶液,产生的沉淀的质量w与所加NaOH溶液的体积V之间有如图所示的关系。求:
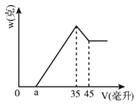
(1)分析图象可知滤液X中所含有的溶质成分为_____(填化学式)。
(2)H2SO4溶液的物质的量浓度是__________?
(3)图中a值为2.3毫升时,铝土矿样品中Fe2O3的质量分数_________________。
(4)a值的变化范围是____________________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(1)反应开始至2min,以气体Z表示的平均反应速率为_________.
(2)该反应的化学方程式为_________.
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:此时体系的压强是开始时的_________倍;达平衡时,容器内混合气体的平均相对分子质量比起始投料时_________(填"增大""减小"或"相等").
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com