
【题目】准确称取6.00克铝土矿样品(含Al2O3、Fe2O3、SiO2),将其放入盛有100毫升H2SO4溶液的烧杯中,充分反应后滤出沉淀物。在滤液X中加入10摩/升的NaOH溶液,产生的沉淀的质量w与所加NaOH溶液的体积V之间有如图所示的关系。求:
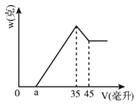
(1)分析图象可知滤液X中所含有的溶质成分为_____(填化学式)。
(2)H2SO4溶液的物质的量浓度是__________?
(3)图中a值为2.3毫升时,铝土矿样品中Fe2O3的质量分数_________________。
(4)a值的变化范围是____________________?
【答案】Al2(SO4)3、Fe2(SO4)3、H2SO4 1.75mol/L 12% 1.625<a<5
【解析】
铝土矿中的氧化铝和氧化铁可以溶于硫酸,二氧化硅不溶于硫酸,过滤后的溶液中肯定含有硫酸铝和硫酸铁,根据图像分析,加入氢氧化钠溶液,先没有沉淀,说明原溶液中含有酸,即酸有剩余,再加入氢氧化钠,铁离子和铝离子分别反应生成氢氧化铁和氢氧化铝沉淀,再加入氢氧化钠溶液,氢氧化铝沉淀溶解,沉淀量减少,最后剩余氢氧化铁沉淀。
(1)根据图像分析,加入氢氧化钠开始没有沉淀,说明酸有剩余,所以得到的滤液中的成分为 Al2(SO4)3、Fe2(SO4)3 、H2SO4 ;
(2)当生成沉淀最大量时,溶液中的溶质为硫酸钠,根据质量守恒分析,氢氧化钠的物质的量为10×0.035=0.35mol,则硫酸的浓度为![]() =1.75mol/L ;
=1.75mol/L ;
(3)根据图像,溶解氢氧化铝消耗的氢氧化钠的物质的量为10×(45-35)×10-3=0.1mol,则生成氢氧化铝消耗的氢氧化钠的物质的量为0.3mol,若a为2.3毫升,则铁离子消耗的氢氧化钠的物质的量为10×0.035-0.3-10×0.0023=0.027mol,则铁离子物质的量为0.009mol,则原混合物中氧化铁的质量分数为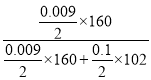 ×100%=12% ;
×100%=12% ;
(4)从前面分析,35毫升氢氧化钠溶液中有30毫升是铝离子沉淀消耗的,若没有氧化铁,则a为5毫升,氧化铝的质量为![]() =5.1克,若剩余6.0-5.1=0.9克全为氧化铁,则氧化铁的物质的量为
=5.1克,若剩余6.0-5.1=0.9克全为氧化铁,则氧化铁的物质的量为![]() mol,沉淀铁离子需要的氢氧化钠的体积为
mol,沉淀铁离子需要的氢氧化钠的体积为![]() =3.375毫升,则a为5-3.375=1.625mL,则a的范围为: 1.625<a<5。
=3.375毫升,则a为5-3.375=1.625mL,则a的范围为: 1.625<a<5。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)氢氧化铝在碱性溶液中的电离方程式为_____。
(2)向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加用硫酸酸化过的H2O2,溶液变红。写出相应反应的离子方程式_____,_____。
(3)右为某烃的球棍模型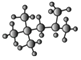 ,其名称(系统命名法)是_____
,其名称(系统命名法)是_____
以下写出相应的化学方程式
(4)铝粉与二氧化锰混合物在高温下反应_____
(5)氢氧化亚铁置于潮湿的空气中_____
(6)向已酸化的FeCl3溶液中加入铜粉_____
查看答案和解析>>
科目:高中化学 来源: 题型:
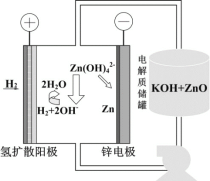
【题目】一种以冷热镀管废料锌灰制ZnSO4·7H2O晶体,进而获取ZnO,并探索氢电极增压还原氧化锌电解法制锌的方法,工艺流程如图所示:
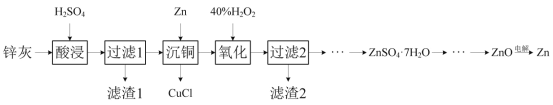
已知:①锌灰的主要成分为ZnO,ZnCl2,还含有SiO2,CuO,PbO和FeO。
②Cu++Cl-=CuCl↓
回答下列问题:
(1)滤渣1的主要成分为SiO2和__。
(2)酸浸时,若硫酸浓度过高,可能发生副反应的化学方程式为__。
(3)写出“沉铜”时的离子方程式__。
(4)在pH为5.6的条件下氧化后,再加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是__。
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH)![]() 离子,每溶解1molZnO需消耗__molKOH。电解池中的总反应离子方程式为:__。
离子,每溶解1molZnO需消耗__molKOH。电解池中的总反应离子方程式为:__。
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S![]() ZnS(s)+2H+。处理后的废水中部分微粒子浓度为:
ZnS(s)+2H+。处理后的废水中部分微粒子浓度为:
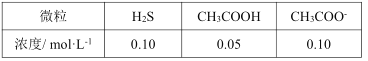
处理后的废水的pH=__,c(Zn2+)=__。
(已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向0.10mol/L的HCOONH4溶液中通入HCl或加入NaOH固体调节溶液pH(忽略溶液体积变化),部分粒子的浓度随pH的变化关系如图所示。其中[NH3]表示溶液中NH3与NH3·H2O的浓度之和,M点的坐标为(6.5,-4)。下列说法不正确的是
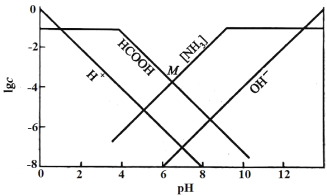
A.此温度下,Kw=1.0×10-14
B.pH<12时,溶液中[NH3]>c(OH-)
C.M点有c(HCOO-)>c(HCOOH)>c(NH4+)>c(H+)>c(OH-)
D.Ka(HCOOH)的数量级为10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9日,最新发现的第113号、115号、117号和118号元素终于有了中文名称

根据元素周期律知识,下列预测或说法肯定不合理的是( )
A. Nh的最高价氧化物对应的水化物的化学式为H3NhO3是一种强酸
B. Mc的最高价阳离子为Mc5+,氧化性比较弱
C. Og是第七周期中的最后一种元素,其原子序数是所有已发现元素中最大的
D. 根据金属和非金属的分界线,Ts的中文名称为“钿”可能更合理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.7g铝粉分别与体积为100mL、浓度均为2mol/L的①硫酸溶液、②烧碱溶液、③盐酸完全反应,放出氢气的体积(相同条件)大小比较正确的是
A.①=②=③B.①=②>③C.①>②>③D.②>①=③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com