
【题目】根据下列实验事实,能得到相应结论的是( )
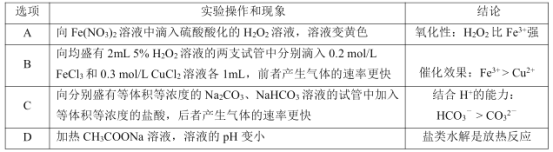
A.AB.BC.CD.D
【答案】B
【解析】
A.向Fe(NO3)2溶液中滴入硫酸酸化的H2O2,溶液变黄色,NO3-在酸性条件下有强氧化性,能氧化Fe2+,则溶液变黄色,Fe2+不一定是被H2O2氧化为Fe3+,故A错误;
B.浓度相等的H2O2溶液中分别滴加等浓度的FeCl3、CuCl2溶液,分解速率不一样,能说明不同催化剂的催化效率不一样,现滴加FeCl3溶液的速率快,即说明Fe3+的催化效果比Cu2+好,故B正确;
C.比较HCO3-与CO32-结合H+的能力,应在等体积等浓度的Na2CO3、NaHCO3溶液的试管中逐滴滴加等浓度的盐酸,并不断振荡,再结合产生气体的速率判断,故C错误;
D.加热促进水的电离,水的离子积常数增大,溶液中OH-不变时,溶液pH也变小,则加热CH3COONa溶液,溶液的pH变小,无法判断水解平衡的移动方向,也无法判断盐类水解是放热反应,事实盐类水解是吸热反应,故D错误;
故答案为B。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种。现做如下实验:
(1)取少量该溶液,滴入用硝酸酸化的AgNO3溶液,有白色沉淀生成。
(2)另取部分溶液,加入氢氧化钠,有白色沉淀产生,加入氢氧化钠的量与生成白色沉淀的量可用右图表示。
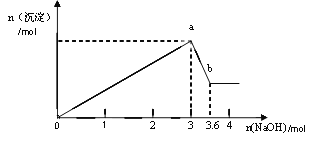
试推断:
(1)该溶液中以上离子一定存在的有___________,一定不存在的有____________。
(2)上述溶液中至少有_____________、(填化学式)等物质混合而成,其物质的量的比为_________。
(3)写出图中a![]() b变化过程的离子方程式_________________。
b变化过程的离子方程式_________________。
(4)为进一步确定溶液中其他的阳离子,应该补充的实验是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某元素的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,各物质转化关系如图所示。下列说法正确的是

A. A是可与草木灰混合使用的肥料 B. C可用排空气法收集
C. F和B能发生复分解反应生成盐 D. B在一定条件下可直接与Y反应生成D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)第四周期元素中价层成对电子数与基态Mg价层成对电子数相等的元素有_________种。
(2)吡咯(平面形结构,结构式为![]() ),N原子杂化方式为______。多原子分子中的大π键可用符号
),N原子杂化方式为______。多原子分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______。
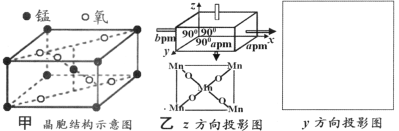
(3)一种锰的氧化物的晶胞如图甲,请写出该氧化物的化学式______。若沿z轴方向观察该晶胞,可得投影图如图乙,请画出沿y轴方向的投影图______。
(4)某含Mg储氢晶体储氢后转化为MgH2,MgH2晶体的结构如图丙,晶胞参数a=b=450pm,c=301pm,原子分数坐标为A(0,0,0)、B(0.305,0.305,0)、C(1,1,1)、D(0.195,0.805,0.5)。
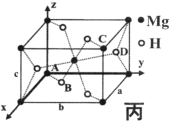
①该晶体中Mg的配位数是__________。
②Mg2+的半径为72pm,则H-的半径为____________pm(列出计算表达式)
③用NA表示阿伏伽德罗常数,则MgH2晶体中氢的密度是标准状况下氢气密度的_______倍(列出计算表达式,氢气密度为0.089g·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构结构简式如图所示。关于M,下列说法正确的是( )
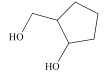
A.分子中所有碳原子可能共平面
B.M的同分异构体中,能与饱和NaHCO3溶液反应有9种
C.可使酸性高锰酸钾溶液褪色
D.1molM与足量的钠反应可以生成22.4LH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取6.00克铝土矿样品(含Al2O3、Fe2O3、SiO2),将其放入盛有100毫升H2SO4溶液的烧杯中,充分反应后滤出沉淀物。在滤液X中加入10摩/升的NaOH溶液,产生的沉淀的质量w与所加NaOH溶液的体积V之间有如图所示的关系。求:
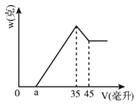
(1)分析图象可知滤液X中所含有的溶质成分为_____(填化学式)。
(2)H2SO4溶液的物质的量浓度是__________?
(3)图中a值为2.3毫升时,铝土矿样品中Fe2O3的质量分数_________________。
(4)a值的变化范围是____________________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
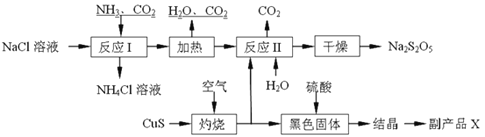
已知:反应Ⅱ包含2NaHSO3![]() Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:____________________________________________。
(2)“灼烧”时发生反应的化学方程式:__________________________________________。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:________________________。
(4)副产品X的化学式是:____________;可循环利用的物质是:__________________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3溶液在工业上用于蚀刻铜箔制造电路板。从蚀刻后的废液中可以回收铜并使蚀刻液再生。流程如下(部分物质有省略):

回答下列问题:
(1)氯化铁溶液蚀刻铜箔反应的离子方程式为_______________________________________。
(2)从固体中分离出铜,加入的试剂X可以是________________。
(3)使滤液再生为蚀刻液可采用的方法是___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com