
����Ŀ����һ��ɫ����Һ�����ܺ�Al3����Fe3����Cu2����Mg2����K����OH����CO32-��Cl�������е������֡���������ʵ�飺
��1��ȡ��������Һ�������������ữ��AgNO3��Һ���а�ɫ�������ɡ�
��2����ȡ������Һ�������������ƣ��а�ɫ���������������������Ƶ��������ɰ�ɫ��������������ͼ��ʾ��
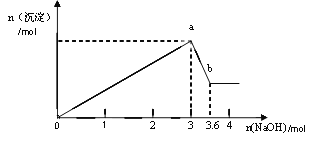
���ƶ�:
��1������Һ����������һ�����ڵ���___________��һ�������ڵ���____________��
��2��������Һ��������_____________�����ѧʽ�������ʻ�϶��ɣ������ʵ����ı�Ϊ_________��
��3��д��ͼ��a![]() b�仯���̵����ӷ���ʽ_________________��
b�仯���̵����ӷ���ʽ_________________��
��4��Ϊ��һ��ȷ����Һ�������������ӣ�Ӧ�ò����ʵ����_____________
���𰸡�Al3����Mg2����Cl�� Fe3����Cu2����OH����CO32- AlCl3��MgCl2 1:1 Al(OH)3+OH��=AlO2-+2H2O �ýྻ��˿պȡ������Һ���ھƾ��ƻ��������գ�����ɫ�ܲ����۲죬�������ɫ������Һ�к�K������û�й۲쵽�������ɫ������Һ�в���K��
��������
������Һ����ɫ���ģ�Fe3������Һ���ػ�ɫ��Cu2������Һ����ɫ����Fe3����Cu2��һ�������ڣ�ȡ��������Һ�������������ữ��AgNO3��Һ���а�ɫ�������ɣ�˵������Һ��һ������Cl������ȡ������Һ����������������Һ������Ϊ���г������������ʧ��˵��ԭ��Һ��һ������Al3����Mg2��������Al3����Mg2����CO32-��OH���ᷴӦ�����ܴ������棬��һ��û��CO32-��OH������K���Ĵ�����������������Ӱ�죬����K�����ܴ��ڣ��ݴ˻ش�
��1��������������������Һ����������һ�����ڵ���Al3����Mg2����Cl����һ�������ڵ���Fe3����Cu2����OH����CO32-��
(2)������Һ�д��ڵ����ӿ���֪��������Һ��������AlCl3��MgCl2�����ʻ�϶��ɣ���ͼ���֪���ܽ�Al(OH)3������3.6-3=0.6molNaOH�����ݻ�ѧ��ӦAl3��+3OH��=Al(OH)3����Al(OH)3+NaOH=NaAlO2+ 2H2O����Al3�������ʵ���Ϊ0.6mol������Al3��������NaOH 0.6��3=1.8mol������Mg2��+2OH��=Mg(OH)2��������Mg2������NaOH�����ʵ���Ϊ3-1.8=1.2mol����Mg2�������ʵ���Ϊ0.6mol�����������ʵ����ı�Ϊ1:1��
��3��ͼ��a![]() b�仯������Al(OH)3��ǿ�Ӧ�ܽ�Ĺ��̣����ӷ���ʽΪAl(OH)3+OH��=AlO2-+2H2O��
b�仯������Al(OH)3��ǿ�Ӧ�ܽ�Ĺ��̣����ӷ���ʽΪAl(OH)3+OH��=AlO2-+2H2O��
��4��K���ļ�������ɫ��Ӧ��Ϊ��һ��ȷ����Һ��K���Ƿ���ڣ�Ӧ�ò����ʵ�����ýྻ��˿պȡ������Һ���ھƾ��ƻ��������գ�����ɫ�ܲ����۲죬�������ɫ������Һ�к�K������û�й۲쵽�������ɫ������Һ�в���K����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������J���������ಡҩ���һ���м��壬���ӽṹ�к���3����Ԫ�����ϳ�·����ͼ��
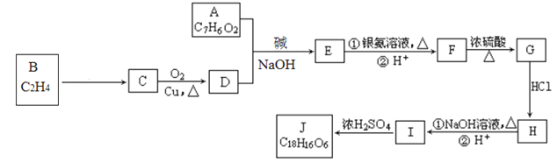
��֪��R1��CHO+ R2��CH2��CHO![]()
![]() ��
��
��ش�
��1����֪��A�ܷ���������Ӧ����![]() ��Һ������ɫ��Ӧ���˴Ź���������ʾ��4��壬�����֮��Ϊ1:2:2:1����A�Ľṹ��ʽ��__��
��Һ������ɫ��Ӧ���˴Ź���������ʾ��4��壬�����֮��Ϊ1:2:2:1����A�Ľṹ��ʽ��__��
��2��J�Ľṹ��ʽ��__��G���������ŵ�������__��
��3��д��A��D��Ӧ����E�Ļ�ѧ����ʽ__��H��I�ķ�Ӧ������__��
��4��������������E���ữ�����ͬ���칹����__�֡�
����������2��ȡ����������FeCl3��Һ������ɫ��Ӧ���ܷ���ˮ�ⷴӦ
��5��������и���Ϣ�������C2H4Ϊԭ�Ϸ�Ӧ�Ʊ�1,3-����ϩ�ĺϳ�·��___�������Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������Ӧ�Լ�������Ӧ�����ӷ���ʽ��ȷ����(������
������ | �����Լ� | ���ӷ���ʽ | |
A | Na���� | Ba(OH��2��Һ | 2Na���� |
B | H����Cl�� | ����ʯ���� | 2H����2OH��=2H2O |
C | K���� | NaHSO4��Һ |
|
D | Ag���� | �������� | Ag���� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������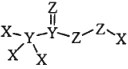 ��һ�ָ�Ч������������������Һ�����к�ǿ��ɱ��������������Ŀǰ�¹ڲ��������µ���������������X��Y��Z Ϊԭ��������������Ķ�����Ԫ�ء�����������ȷ����
��һ�ָ�Ч������������������Һ�����к�ǿ��ɱ��������������Ŀǰ�¹ڲ��������µ���������������X��Y��Z Ϊԭ��������������Ķ�����Ԫ�ء�����������ȷ����
A.ԭ�Ӱ뾶��X>Y>Z
B.Ԫ�صķǽ����ԣ�X<Y<Z
C.�û�������Z�Ļ��ϼ۾���-2 ��
D.�û������� X��Y��Z������ 8 �����ȶ��ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Σ����Ϊ���صĴ�����Ⱦ��֮һ,����Ҫ���Ի�ʯȼ�ϵ�ȼ��,�о�CO����ԭSO2����������,��ȼú�糧�����������о�����Ҫ��ֵ��
��.������ѧ�Ƕ��о���Ӧ
(1) C(s)+O2(g)![]() CO2(g) ��H1=-393.5 kJ��mol-1
CO2(g) ��H1=-393.5 kJ��mol-1
CO2(g)+C(s)![]() 2CO(g) ��H2=+172.5 kJ��mol-1
2CO(g) ��H2=+172.5 kJ��mol-1
S(s)+O2(g)![]() SO2(g) ��H3=-296.0 kJ��mol-1
SO2(g) ��H3=-296.0 kJ��mol-1
д��CO ��ԭSO2���Ȼ�ѧ����ʽ:_________________��
(2)����CO��ԭSO2�ķ�Ӧ,����˵����ȷ����______��
A.�ں��º���������,����Ӧ��ϵѹǿ����,��Ӧ�Ѵﵽƽ��״̬
B.ƽ��״̬ʱ,2v��(CO)=v��(SO2)
C.������������,����SO2��Ũ��,CO��ƽ��ת��������
D.�ں��º�ѹ��������,��ﵽƽ��״̬����ϵ�г���N2,SO2��ƽ��ת���ʲ���
��NOx���ŷ���Ҫ����������β��������NO2��NO����������û���̿��NOx����������������Ӧ���£�
��Ӧa��C(s)+2NO(g)![]() N2(g)+CO2(g) ��H=��34.0kJ/mol
N2(g)+CO2(g) ��H=��34.0kJ/mol
��Ӧb��2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ��H=��64.2kJ/mol
N2(g)+2CO2(g) ��H=��64.2kJ/mol
(3)���ڷ�Ӧa����T1��ʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
ʱ��(min) Ũ��(mol��L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
��0~10min�ڣ�NO��ƽ����Ӧ����v(NO)=___________�������߷�Ӧ�¶ȣ��÷�Ӧ��ƽ�ⳣ��K___________(ѡ����������������С������������)��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣻�����ϱ��е������жϸı������������___________(����ĸ)��
A������һ�����Ļ���̿ B��ͨ��һ������NO
C���ʵ���С��������� D��������ʵĴ���
(4)��ijʵ����ģ�ⷴӦb�����ܱ������м���������C��һ������NO2���壬ά���¶�ΪT2�棬��ͼΪ��ͬѹǿ�·�Ӧb������ͬʱ��NO2��ת��������ѹǿ�仯��ʾ��ͼ����Ӷ���ѧ�Ƕȷ�����1050kPaǰ����Ӧb��NO2ת��������ѹǿ����������ԭ��_____________����1100kPaʱ��NO2���������Ϊ___________��
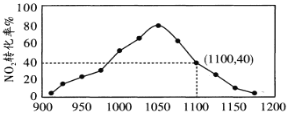
����ij���ʵ�ƽ���ѹ���������ʵ���Ũ��Ҳ���Ա�ʾ��ѧƽ�ⳣ��(����Kp)����T2�桢1.1��106Paʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp=___________(�������ʽ��ʾ)����֪�������ѹ(P��)=������ѹ(P��)�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�ǰ�߸պ��Ǻ����������� (����)
A. 2 mol H2O��Ħ��������1 mol H2O��Ħ������
B. 200 mL 1 mol��L-1�Ȼ�����Һ��c(Cl-)��100 mL 2 mol��L-1�Ȼ�����Һ��c(Cl-)
C. 64 g������������ԭ�����ͱ�״����22.4 Lһ����̼����ԭ����
D. 20% NaOH��Һ��NaOH�����ʵ���Ũ�Ⱥ�10% NaOH��Һ��NaOH�����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼���������ܹ�ע��CO2�IJ����ż������ó�Ϊ��ѧ���о�����Ҫ���⡣̫�ղղ����� CO2�����з�Ӧ������ʵ�� O2��ѭ�����á�
Sabatier ��Ӧ��CO2(g)+4H2(g)CH4(g)+2H2O(g)
ˮ��ⷴӦ��2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g)
(1)��ԭ������ n(CO2)�� n(H2)=1��4 �����ܱ������з��� Sabatier ��Ӧ�����H2O(g)�����ʵ����������¶ȵĹ�ϵ��ͼ��ʾ(���߱�ʾƽ������)��
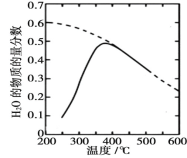
�ٸ÷�Ӧ��ƽ�ⳣ�� K ���¶����߶�________(����������������С��)��
���¶ȹ�����;������ڸ÷�Ӧ�Ľ��У�ԭ����________��
�����д�ʩ����� CO2 ת��Ч�ʵ���________(����)��
A. �ʵ���ѹ
B. ��������ıȱ����
C. ��Ӧ��ǰ�μ��ȣ������ȴ
D. ���ԭ������ CO2 ��ռ����
E. �������Ʒ�Ӧ�������������
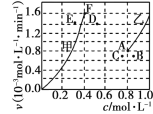
(2)��һ������ CO2(g)�� CH4(g)ͨ��һ�����ܱ������з�����Ӧ��CO2(g)��CH4(g)2CO(g)��2H2(g) �� H ����248 kJ��mol��1��
Ϊ��̽���÷�Ӧ�ķ�Ӧ������Ũ�ȵĹ�ϵ����ʼʱ������ܱ�������ͨ��CO2 ��CH4 ��ʹ�����ʵ���Ũ�Ⱦ�Ϊ1.0mol��L��1��ƽ��ʱ������������ݻ��Ƴ�������Ӧ������Ũ�ȹ�ϵ������ͼ�� v���� c(CH4)�� v�� �� c(CO)������ v���� c (CH4)���Ӧ������ͼ��________(����������������)���÷�Ӧ�ﵽƽ���ijһʱ�̽����¶ȷ�Ӧ���´ﵽƽ�⣬���ʱ����Ӧ��ƽ������Ϊ________(����D����E������F��)��
(3)��ϡ��ˮ�������� CO2���տɵò�ƷNH4HCO3���ڲ���ʱ�����������м��� NH2COONH4(���������)���ɡ��ֽ�һ���������İ�����������ں����ܱ������У��ֱ��ڲ�ͬ�¶��½��з�Ӧ��NH2COONH4(s) 2NH3(g)��CO2 (g)��ʵ���õ��й����ݼ��±�( t1 < t2 < t3 )
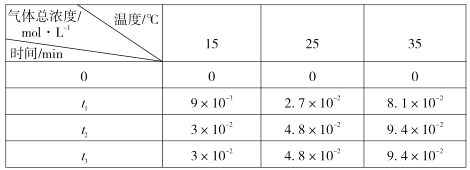
��������立ֽⷴӦ��________(��������������������)��Ӧ��15��ʱ�˷�Ӧ�Ļ�ѧƽ�ⳣ�� K ��________��
(4)һ���µ�ѭ�����÷������� Bosch ��Ӧ CO2(g)+2H2(g) C(s)+2H2O(g)���� Sabatier ��Ӧ��
�� ��֪ CO2(g)��H2O(g)�������ʷֱ�Ϊ�C394 kJmol��1 ���C242 kJmol��1 ��Bosch ��Ӧ���� H ��________kJmol��1(������ָһ���������ɶ�Ӧ�������� 1mol ������ʱ�ķ�Ӧ��)��
��һ�������� Bosch ��Ӧ�����ڸ����²���������ԭ����________��
�۸��·������ŵ���________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���к�NaCl��Na2SO4��NaNO3�Ļ���ѡ���ʵ����Լ�����ת��Ϊ��Ӧ�ij�������壬�Ӷ�ʵ��Cl����SO42����NO3��������롣��Ӧ��ʵ����̿�����ͼ��ʾ��
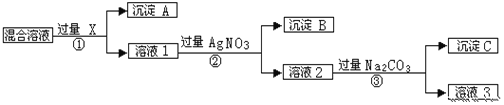
��ش��������⣺
�ٳ���A�Ļ�ѧʽ��________
�ڹ��̢��м��������Na2CO3��Ŀ����_______________
�۰���ʵ�鷽���õ�����Һ3�б�ԭ��Һ����___________����(�ѧʽ)����ȥ�����ӵķ�����_________
��Ϊ�˾�������ȫ�����������ӣ�����٢ڢ۹��˺���Ҫϴ�ӣ�������ϴ�Ӳ���_____________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com