
可逆反应:2NO2 2NO+O2 在密闭容器中反应,达到平衡状态的标志是:( )
2NO+O2 在密闭容器中反应,达到平衡状态的标志是:( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B.②③⑤ C.①③④ D. ①②③④⑤⑥
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
原子序数依次增大的X、Y、Z、W、M五种短周期元素,其中只有Y、Z、W同周期,X、M同主族;Y的单质是天然存在的最硬的物质;Z、W的单质为空气的主要成分。下列各项中正确的是
A.X、M可以形成MX型离子化合物
B.Y、Z、W三种元素的气态氢化物的沸点依次降低
C.M2W2与X2W2的晶体是同种类型的晶体
D.原子半径:M>W>Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是
A.丙烯的结构简式:C3H6
B.氢氧根离子的电子式: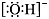
C.氯原子的结构示意图:
D.中子数为146、质子数为92的铀(U)原子14692U
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废铁屑表面常有铁锈(成分为Fe2O3),并沾有油污。某校研究性学习小组设计实验方案,按以下①~④步骤用废铁屑制备绿矾(FeSO4·7H2O)晶体。
废铁屑 铁屑
铁屑
 溶液(留有少量铁屑)
溶液(留有少量铁屑)
 滤液
滤液 绿矾晶体
绿矾晶体
根据该实验方案,回答下列问题:
(1)步骤①中废铁屑与NaOH溶液共热的目的是________________________________________________。
(2)步骤②中烧杯底部留有少量铁屑的理由是________________________________________________。
说明剩余铁屑作用的离子方程式为______________________________________________。
(3)在步骤③中,该小组采用如图抽气过滤(减压过滤)装置代替普通漏斗,其目的是________;________。

(4)检查步骤③的滤液中没有Fe3+的方法是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol•L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A. 加少量烧碱溶液 B. 加醋酸钠 C. 加少量冰醋酸 D. 加水
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
A.Na2O、Na2O2组成元素相同,推出与水反应产物也完全相同
B.SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强
C.H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO
D.根据常温下铜与浓硝酸可以制取NO2,推出常温下铁与浓硝酸也可以制取NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组比值为1∶2的是( )
A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比
B.0.1 mol/L H2S溶液,c(S2-)与c(H+)之比
C.pH=10的Ba(OH)2溶液与pH=10的氨水,溶质的物质的量浓度之比
D.pH=3的硫酸与pH=3的醋酸溶液,c(SO42-)与c(CH3COO-)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为________________________。
(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。
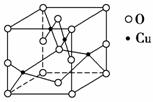
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
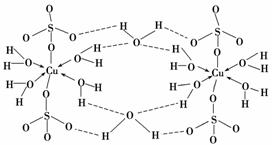
下列说法正确的是________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因_______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质:①Cl2;②Na2CO3;③NaHCO3;④K—Na合金;⑤Na。
(1)广泛用于玻璃、制皂、造纸、纺织工业的是 (填编号,下同)
(2)可用于消毒的是
(3)可用作原子反应堆的导热剂的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com